Tác giả: Ari Meerson, Soliman Khatib, Jamal Mahajna
Biên dịch và Hiệu đính: Bác sĩ Hoàng Đôn Hòa | Viện Y học bản địa Việt nam | 0889999466
Tóm tắt
Các tế bào gốc ung thư (CSC) đã được xác định trong một số loại khối u rắn. Trong một số trường hợp, CSC có thể là nguồn gốc của tất cả các tế bào khối u, nguyên nhân gây ra khả năng kháng thuốc hóa trị của khối u và nguồn gốc của các tế bào di căn. Do đó, liệu pháp phối hợp nhắm mục tiêu vào các tế bào khối u không phải CSC cũng như đặc biệt nhắm mục tiêu vào CSC có khả năng mang lại hiệu quả cao. Các sản phẩm tự nhiên (NP) từ trước đến nay là nguồn phong phú các hợp chất hoạt tính sinh học và được biết đến với khả năng tác động đồng thời vào nhiều con đường tín hiệu với tác dụng phụ không đáng kể. Trong bài đánh giá này, chúng tôi thảo luận về tiềm năng của NP trong việc nhắm mục tiêu nhiều con đường tín hiệu trong CSC và tiềm năng của chúng trong việc tăng cường hiệu quả của liệu pháp điều trị ung thư tiêu chuẩn. Cụ thể, chúng tôi tập trung vào các hoạt động chống CSC của flavonoid, các loại thuốc được FDA chấp thuận có nguồn gốc từ tự nhiên. Ngoài ra, chúng tôi nhấn mạnh tiềm năng của NP trong việc nhắm mục tiêu tín hiệu qua trung gian microRNA, do vai trò của microRNA trong việc duy trì kiểu hình CSC.
1. Giới thiệu
Trong những năm gần đây, các phương pháp điều trị ung thư hiện đại đã đạt được tiến bộ đáng kể trong điều trị nhiều khối u rắn. Tuy nhiên, sự tái phát ung thư là không thể tránh khỏi ở hầu hết các bệnh ung thư, một phần do sự tồn tại của một tập hợp nhỏ các tế bào khối u kháng trị liệu, được gọi là tế bào gốc ung thư (CSC). CSC được mô tả là thuộc về một nhóm tế bào khởi tạo khối u (TIC) sở hữu các đặc điểm giống tế bào gốc. Vai trò của CSC trong việc hình thành khối u lần đầu tiên được Bonnet và Dick mô tả vào cuối những năm 1990, và rõ ràng là CSC đóng một vai trò quan trọng trong sự phát triển và tái phát khối u đối với nhiều loại ung thư. Các phương pháp điều trị truyền thống, chẳng hạn như hóa trị và xạ trị, ban đầu được phát triển để tiêu diệt phần lớn các tế bào phân chia nhanh chóng trong khối u. Tuy nhiên, trong khi các liệu pháp này có thể làm teo khối u, nhưng hiệu quả thường chỉ là nhất thời và sự tái phát vẫn là thực tế đối với một tỷ lệ đáng kể bệnh nhân ung thư. Mặc dù đã loại bỏ phần lớn khối u, nhưng những phương pháp điều trị này đã tỏ ra không đủ để loại bỏ quần thể CSC. Ví dụ, các tế bào gốc ung thư thần kinh đệm CD133+ đã được chứng minh là có khả năng kháng xạ trị ở mức độ cao hơn so với các tế bào CD133-. CSC vú thể hiện khả năng kháng xạ trị ngoài các phương pháp hóa trị thông thường
. Do đó, các CSC còn lại sau liệu pháp điều trị ung thư tiêu chuẩn cuối cùng sẽ hình thành các khối u mới, phát triển đầy đủ. Việc loại bỏ hoàn toàn và ngăn ngừa ung thư tái phát đòi hỏi phải loại bỏ quần thể tế bào gốc trong khối u. Liệu pháp phối hợp thuốc nhắm mục tiêu các tế bào khối u không phải CSC với các liệu pháp đặc biệt nhắm mục tiêu CSC có thể là phác đồ hiệu quả nhất trong điều trị ung thư (Hình 1)

2. Đặc điểm của CSC
Các tế bào gốc ung thư (CSC) đã được xác định trong một số loại khối u rắn, bao gồm ung thư vú, khối u não, ung thư phổi, ung thư đại trực tràng và khối u ác tính. Các tế bào gốc ung thư có khả năng tự đổi mới, tạo ra các tế bào con khác biệt với chúng và sử dụng các con đường tín hiệu chung. Tế bào gốc ung thư có thể là nguồn gốc của tất cả các tế bào khối u hiện diện trong một khối u ác tính, nguyên nhân gây ra sự kháng thuốc hóa trị được sử dụng để điều trị khối u ác tính và nguồn gốc của các tế bào tạo ra các di căn xa. Ngày càng có nhiều bằng chứng cho thấy đặc điểm CSC khác nhau giữa các loại ung thư và thậm chí trong các khối u của từng bệnh nhân thuộc cùng một phân nhóm. Dưới đây là một số dấu hiệu chung của nhiều CSC ở các loại khối u khác nhau.
Tự làm mới: CSC là một quần thể tế bào tự làm mới với khả năng gây ung thư cao. Tự làm mới được định nghĩa là khả năng trải qua nhiều chu kỳ phân chia tế bào, đồng thời duy trì trạng thái chưa biệt hóa. Điều này đòi hỏi sự kiểm soát chu kỳ tế bào và thường duy trì đa năng hoặc toàn năng. Các chương trình tự làm mới liên quan đến các mạng lưới cân bằng các proto-oncogenes (thúc đẩy tự làm mới), các chất ức chế khối u giữ cổng (hạn chế tự làm mới) và các chất ức chế khối u chăm sóc (duy trì tính toàn vẹn của bộ gen). Trong một số tế bào gốc, quá trình tự làm mới bị mất kiểm soát, dẫn đến sự mở rộng của các tế bào này và hình thành các khối u. WNT/β-catenin, yếu tố tăng trưởng chuyển đổi-β, Hedgehog và Notch là những tín hiệu quan trọng để duy trì khả năng tự làm mới trong CSC.
Khả năng EMT: Chuyển đổi biểu mô – trung mô (EMT) là quá trình mà các tế bào biểu mô trải qua, trong đó các tế bào thay đổi hình thái, mất cực và phá vỡ các liên kết tế bào – tế bào hoặc tế bào – chất nền. Bằng cách này, các tế bào có được khả năng di chuyển và xâm lấn tiềm ẩn. CSC được cho là có khả năng EMT nâng cao, cho phép các tế bào tồn tại trong trường hợp không có sự kết dính tế bào ngoài việc tăng cường khả năng chống lại quá trình chết theo chương trình (apoptosis). CSC đã trải qua EMT được cho là sau đó gắn lại và tạo ra các khối u di căn hoặc lưu thông khắp cơ thể ở trạng thái không hoạt động, chỉ hoạt động trở lại sau nhiều năm và gây ra sự tái phát ung thư ở xa.
Kháng thuốc: Kháng thuốc thường liên quan đến quần thể CSC. Kháng thuốc ở CSC được điều hòa một phần bởi các chất vận chuyển gắn ATP (ATP-binding cassette – ABC) được biểu hiện quá mức trong CSC. Các chất vận chuyển ABC là các protein xuyên màng đóng vai trò bảo vệ tế bào quan trọng đối với các tế bào gốc khỏe mạnh trên khắp cơ thể bằng cách loại bỏ các hợp chất độc hại từ bên trong tế bào. Các thành viên của họ chất vận chuyển ABC dường như được biểu hiện cao trong CSC bao gồm ABCB1, ABCG2 và ABCB5. ABCB1 góp phần vào dòng chảy ra của nhiều tác nhân hóa trị được sử dụng rộng rãi. Giảm biểu hiện của ABCB1 đã được chứng minh là làm tăng độ nhạy hóa trị của CSC đại trực tràng. Bằng cách nhắm mục tiêu các chất vận chuyển ABC, về mặt lý thuyết, có thể đảo ngược khả năng kháng thuốc độc đáo của CSC, khiến chúng nhạy cảm với các phương pháp điều trị hóa trị truyền thống.
Hình thành khối u: Khả năng EMT được đánh giá bằng cách loại bỏ mọi cơ hội gắn kết tế bào. Khi ở trong những điều kiện này, các tế bào không có khả năng EMT sẽ chết, chỉ để lại các tế bào đã trải qua quá trình chuyển đổi. Các tế bào còn lại thường phát triển thành thứ được gọi là khối u, được làm giàu CSC trong nhiều mô.
3. Dấu hiệu CSC
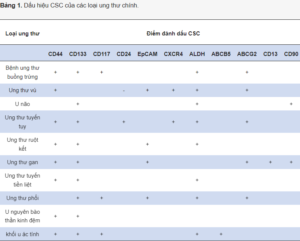
Một số dấu ấn sinh học được tìm thấy biểu hiện quá mức trên CSC của hầu hết các khối u rắn như CD44 (thụ thể hyaluronate), CD133 (prominin-1), EpCAM (bám dính tế bào biểu mô), ALDH (aldehyde dehydrogenase 1A1) và ABCG2 (ATP-Binding Cassette Sub-family G Member 2). Tuy nhiên, các dấu ấn khác được biểu hiện quá mức trên CSC của một tập hợp con các loại khối u như CD117 (c-kit) trong ung thư thần kinh đệm, ung thư buồng trứng và ung thư phổi; CD24 (kháng nguyên ổn định nhiệt) trong ung thư tuyến tụy; CXCR4 (thụ thể chemokine) trong ung thư tuyến tụy và ung thư vú; CD90 (biệt hóa tế bào thymocyte) trong ung thư vú và ung thư đại trực tràng, CD49f (Integrin α6) trong ung thư tuyến tiền liệt (Bảng 1). Điều thú vị là tế bào gốc bệnh bạch cầu (LCS) dương tính với CD34 (kháng nguyên tế bào tiền thân tạo máu) và âm tính với CD38 (cyclic ADP ribose hydrolase).
CD44 dương tính: Các protein nhóm biệt hóa 44 (CD44) là các glycoprotein màng tích hợp đóng vai trò trong việc gắn kết tế bào với chất nền ngoại bào bằng cách liên kết với hyaluronan (HA). Sự biểu hiện của CD44 đã được sử dụng như một dấu ấn giả định cho các tế bào gốc ung thư. CD44 điều chỉnh sự tăng trưởng, di chuyển và đặc tính xâm lấn của CSC ngoài việc sửa đổi chất nền ngoại bào của các mô để hỗ trợ sự hình thành khối u mới. CD24 là một loại protein bề mặt tế bào khác và là một kháng nguyên ổn định nhiệt; sự biểu hiện của nó là một dấu ấn để dự đoán kết quả lâm sàng và sự biểu hiện của các gen liên quan đến tính gốc khác, cùng với CD44.
CD133 dương tính: Nhóm biệt hóa 133 (CD133) là một loại protein bề mặt màng pentaspan cũng thường được sử dụng làm chất chỉ thị CSC trong nhiều loại ung thư . Biểu hiện CD133 có tương quan thuận với kết quả kém đối với bệnh nhân ung thư.
ESA hoặc epCAM: Kháng nguyên đặc hiệu biểu mô (ESA), còn được gọi là phân tử kết dính tế bào biểu mô (epCAM) là một dấu ấn bề mặt thường được biểu hiện trên các tế bào biểu mô và đã được sử dụng để xác định CSC trong nhiều loại ung thư. ESA điều chỉnh sự bám dính tế bào với tế bào, di chuyển và xâm lấn của các tế bào ung thư.
Quần thể phụ: Mặc dù các đặc điểm của CSC dường như khác nhau giữa các loại khối u, tuy nhiên một số đặc điểm chính được chia sẻ bởi hầu hết các loại ung thư. Hoechst 33342 là một loại thuốc nhuộm có khả năng thấm qua màng tế bào nguyên vẹn, tạo ra huỳnh quang xanh lam khi liên kết với DNA hạt nhân. Các tế bào loại trừ Hoechst 33342, còn được gọi là quần thể phụ (SP), của các khối u đã được nghiên cứu như một nguồn CSC kháng thuốc. Khả năng SP loại trừ Hoechst 33342 là kết quả của các chất vận chuyển ABC, cụ thể là ABCG2, khiến việc phân lập SP trở thành một phương pháp gián tiếp để phân lập CSC dựa trên sự biểu hiện của chất vận chuyển ABC.
Hoạt động ALDH: Hoạt động của aldehyde dehydrogenase (ALDH) đã được sử dụng để xác định CSC. ALDH xúc tác quá trình oxy hóa các aldehyd đi vào hoặc được tạo ra trong cơ thể. Bằng cách oxy hóa các aldehyd, các enzym này biến đổi các hợp chất có khả năng gây hại thành axit cacboxylic, chuẩn bị chúng cho quá trình trao đổi chất của tế bào và do đó góp phần bảo vệ CSC khỏi các phương pháp điều trị hóa học. Bằng cách loại bỏ hoạt động ALDH khỏi các khối u, có thể làm chậm sự phân hủy các tác nhân hóa trị trong khối u, dẫn đến điều trị hiệu quả hơn. Các hợp chất gây độc tế bào không hoạt động như chất nền cho các enzym ALDH hoặc làm giảm hoạt động của chúng có thể có khả năng độc đáo gây ra quá trình chết theo chương trình trong CSC và hoạt động như những phương pháp điều trị lâu dài hiệu quả hơn.
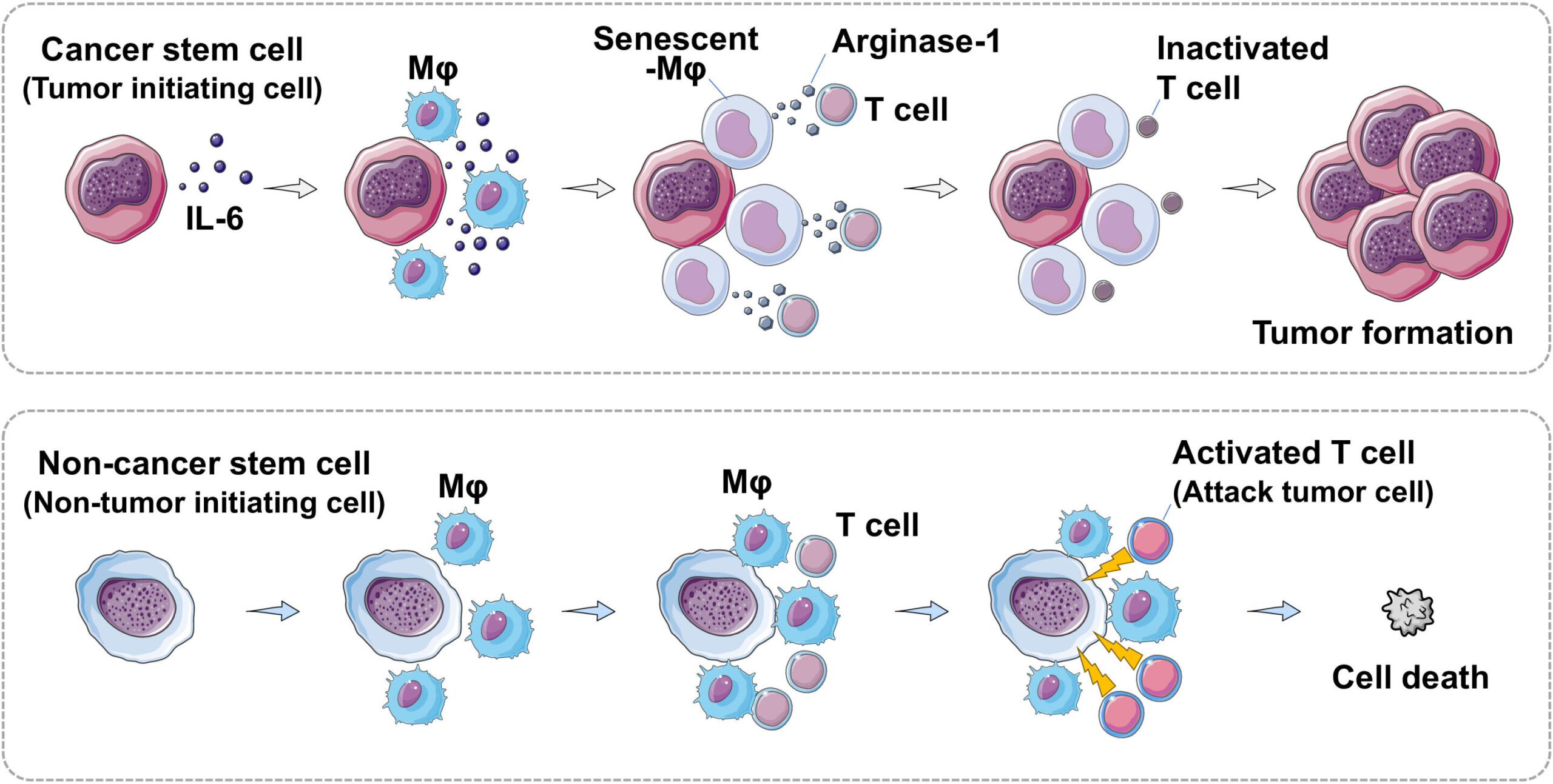
Sự hình thành CSC được cho là do vi môi trường khối u. Nhất quán với điều này, vi môi trường khối u đã được chứng minh là góp phần vào tính dẻo của tế bào trong quá trình phát triển khối u, khởi tạo các chương trình giống tế bào gốc trong các tế bào không phải CSC hoặc tế bào bình thường và liên quan đến các tín hiệu quan trọng, chẳng hạn như đường dẫn Wnt hoặc các dấu hiệu liên quan đến viêm. Các tế bào vi môi trường có thể ảnh hưởng lớn đến sự duy trì và hành vi của CSC bằng cách điều chỉnh các thay đổi chuyển hóa và sự tiết các yếu tố tăng trưởng / cytokine. Vi môi trường khối u ảnh hưởng đến sự cảm ứng kiểu hình chuyển đổi biểu mô – trung mô (EMT) cần thiết cho sự tạo thành CSC, cũng như làm tăng số lượng và khả năng đổi mới của CSC và cảm ứng các yếu tố phiên mã liên quan đến đa năng, chẳng hạn như Oct-3/4, Nanog và Sox-2. Điều thú vị là CSC dường như có các tính năng trốn tránh miễn dịch độc đáo, bao gồm biểu hiện quá mức các phân tử PD-1/PD-L1, cho thấy tiềm năng của liệu pháp miễn dịch để loại bỏ CSC trong các khối u khác nhau.
4. Các sản phẩm tự nhiên
Các sản phẩm tự nhiên (NPs) từ trước đến nay là một nguồn phong phú các hợp chất hoạt tính sinh học với cấu trúc hóa học đa dạng cho ngành dược phẩm. NP cũng được biết đến với khả năng tác động đồng thời vào nhiều con đường tín hiệu với tác dụng phụ không đáng kể. Trong bài đánh giá này, chúng tôi sẽ tập trung vào các hoạt động chống CSC của flavonoid và các loại thuốc được FDA phê duyệt có nguồn gốc tự nhiên. Hầu hết các báo cáo được xem xét trong nghiên cứu này đều trình bày dữ liệu sử dụng các hệ thống nuôi cấy mô. Hơn nữa, một số nghiên cứu về hoạt động chống CSC của NP được xem xét cũng đã được thực hiện bằng cách sử dụng mô hình động vật. Tuy nhiên, chỉ có một vài ví dụ về các nghiên cứu lâm sàng cho thấy hoạt động chống CSC của NP được trình bày.
Hiểu biết sâu sắc hơn về sinh học CSC đã tiết lộ tầm quan trọng của chức năng ty thể trong sự tồn tại của CSC, duy trì CSC và nhu cầu trao đổi chất và năng lượng của chúng. Mặc dù một số flavonoid như quercetin và apigenin đã gây ra quá trình apoptosis tế bào theo cách phụ thuộc vào ty thể, nhưng tác động của flavonoid lên chức năng ty thể và tác động của chúng đối với sự tồn tại và duy trì CSC không phải là trọng tâm của bài đánh giá này.
5. Flavonoid nhắm mục tiêu các tế bào gốc ung thư (CSC)
Flavonoid là polyphenol trong chế độ ăn uống có trong nhiều loại thực vật, trái cây, rau, quả hạch và trà. Hơn 6000 flavonoid đã được phân lập, xác định và chia thành các phân lớp như flavone, flavonol, flavanol, isoflavone và isoflavans. Quercetin và Kaempferol là những flavonol nổi bật nhất trong thực phẩm, Luteolin và Apigenin là những flavone nổi bật, Genistein và Daidzein là những isoflavone nổi bật có trong đậu nành và catechin là thành phần nổi bật nhất của trà xanh. Flavonoid đã được quan tâm khoa học cao kể từ những năm 1990 do tác dụng có lợi của chúng đối với sức khỏe con người. Tiêu thụ flavonoid có thể góp phần ngăn ngừa các bệnh tim mạch, thoái hóa thần kinh và ung thư. Gần đây, ngày càng có nhiều bằng chứng về tác dụng ngăn ngừa của flavonoid đối với tế bào gốc ung thư.
Erdogan và cộng sự đã mô tả tác dụng của quercetin đối với sự sống còn và di chuyển của tế bào gốc ung thư tuyến tiền liệt (PCSC). Các tác giả đã kiểm tra tác dụng của quercetin trên các tế bào gốc CD44+/CD133+ và CD44+ được phân lập từ các tế bào ung thư tuyến tiền liệt (tương ứng là tế bào PC3 và LNCaP). Quercetin ức chế sự sống còn của PC3 và CD44+/CD133+ theo cách phụ thuộc vào liều lượng và thời gian. Midkine (MK) là một cytokine liên kết heparin đa chức năng với các chức năng chống apoptosis, thúc đẩy di chuyển, tạo mạch và các chức năng sinh học khác. Việc sử dụng quercetin cho các tế bào loại bỏ MK dẫn đến sự ức chế tăng sinh tế bào cao hơn so với việc sử dụng quercetin và MK siRNA đơn độc ở cả tế bào không nhạy cảm androgen và tế bào nhạy cảm androgen. Sự kết hợp của quercetin và MK siRNA có thể thúc đẩy đáng kể quá trình apoptosis và ức chế sự di chuyển của các tế bào PC3 và CD44+/CD133+ thông qua việc điều chỉnh giảm biểu hiện của các con đường tín hiệu PI3K/PTEN, MAPK và NF-κB. Tsai và cộng sự đã sử dụng các tế bào gốc ung thư tuyến tiền liệt DU145-III được phân lập từ dòng tế bào khối u tuyến tiền liệt DU145 (DU145-P) để khám phá tác dụng của quercetin đối với các tế bào gốc ung thư tuyến tiền liệt. Quercetin ức chế khả năng di chuyển và xâm lấn cũng như bắt chước mạch máu (VM) trong các tế bào DU145-III. Nó làm giảm biểu hiện của các dấu hiệu CSC CD44, ABCG2, Sox2 và Nanog, làm suy yếu sự hình thành khối cầu liên quan đến tế bào gốc ung thư và ức chế con đường tín hiệu JNK. Wei và cộng sự cũng đã kiểm tra tác dụng ức chế của quercetin đối với khả năng tự đổi mới của tế bào gốc ung thư vú (BCSC), bằng cách sử dụng xét nghiệm hình thành mammosphere trong các tế bào AS-B145 và ASB244 của người. Quercetin ức chế kích thước và số lượng của các mammosphere nguyên phát và thứ phát theo cách phụ thuộc vào liều lượng. Kết quả tương tự thu được khi sử dụng BCSC chuột Sca-1+4T1.
Trong một nghiên cứu khác, Cao và cộng sự đã chỉ ra rằng điều trị bằng quercetin có thể khắc phục tình trạng kháng thuốc hóa trị như gemcitabine của tế bào ung thư tuyến tụy bằng cách thể hiện sức mạnh tổng hợp đáng kể với các loại thuốc hóa trị tiêu chuẩn và đảo ngược MDR. Hơn nữa, Slusarz và cộng sự đã xác định quercetin là một chất ức chế con đường tín hiệu hedgehog, liên quan đến sinh học tế bào gốc ung thư, trong ung thư tuyến tiền liệt.
Luteolin: Luteolin (LU) là một flavone được tìm thấy trong hơn 300 loài thực vật, nhiều loại trong số đó có sẵn trong chế độ ăn uống của con người. Giống như quercetin, luteolin được phát hiện là ức chế đặc tính CSC và di căn trong PCSC phân lập, Du145-III. Hơn nữa, luteolin ức chế EMT và di chuyển tế bào trong các tế bào ung thư âm tính triple. Ma và cộng sự báo cáo rằng luteolin ức chế sự sống còn và khả năng tự đổi mới của các tế bào giống tế bào gốc ung thư gan. Luteolin cũng có thể ảnh hưởng đến số lượng và kích thước của các khối cầu khối u.
Sử dụng các khối u dị ghép ung thư vú ở người trên chuột nude, Cook và cộng sự đã chỉ ra rằng luteolin làm giảm khả năng sống của tế bào ung thư vú, biểu hiện VEGF của khối u dị ghép và mật độ mạch máu. Hơn nữa, luteolin đã ngăn chặn việc MPA gây ra các đặc tính giống tế bào gốc của các tế bào ung thư vú. Cũng đã chỉ ra rằng luteolin ức chế các dấu hiệu tế bào gốc khác nhau như CD44, ALDH1 và các dấu hiệu khác trong các tế bào ung thư vú.
Tu và cộng sự đã nghiên cứu tác dụng của luteolin đối với tế bào gốc ung thư miệng (OCSC) bằng cách sử dụng tế bào S biểu mô nướu bình thường của người và dòng tế bào OCSC. Luteolin ức chế hiệu quả tốc độ tăng sinh, khả năng tự đổi mới, hoạt động aldehyde dehydrogenase 1 và CD44 dương tính của OCSC bằng cách bất hoạt tín hiệu IL-6 / STAT3. Luteolin phục hồi độ nhạy phóng xạ trong OCSC. Sự kết hợp giữa luteolin và xạ trị cho thấy tác dụng hiệp đồng đối với khả năng xâm lấn và tạo dòng vô tính của OCSC. Điều thú vị là luteolin không gây độc tế bào đáng kể ở các tế bào biểu mô bình thường.
Chakrabarti và cộng sự đã chỉ ra rằng luteolin và silibinin có tác dụng hiệp đồng đối với việc ức chế tế bào gốc u nguyên bào thần kinh đệm (GbSC). Nghiên cứu của họ đã chứng minh rằng sự kết hợp của luteolin và silibinin ức chế hiệu quả sự tăng sinh, di chuyển và xâm lấn cũng như gây ra quá trình apoptosis thông qua việc điều hòa giảm PKCα và iNOS trong các tế bào SNB19 u nguyên bào thần kinh đệm ở người và các tế bào GbSC.
Erdogan và cộng sự đã kiểm tra tác dụng của apigenin đối với CSC tuyến tiền liệt (CD44+) được phân lập từ các tế bào ung thư tuyến tiền liệt ở người (PC3). Apigenin ức chế sự sống sót và di chuyển của PCSC và tế bào PC3 theo cách phụ thuộc vào liều lượng, gây ra apoptosis thông qua một con đường phụ thuộc caspase bên ngoài và làm giảm biểu hiện protein Oct3/4, một dấu hiệu đa năng, có thể liên quan đến việc điều hòa giảm tín hiệu PI3K/Akt/NF-κB.
Ketkaew và cộng sự đã sử dụng dòng tế bào ung thư biểu mô vảy đầu và cổ HN-30 để kiểm tra tác dụng của apigenin đối với CSC biểu mô vảy. Các tế bào HN-30 cho thấy sự biểu hiện của các dấu hiệu tế bào gốc do thiếu oxy gây ra. Apigenin làm giảm đáng kể khả năng sống của tế bào HN-30 theo cách phụ thuộc vào liều lượng và thời gian và điều hòa giảm đáng kể biểu hiện của các dấu hiệu CD44, NANOG và CD105.
Kim và cộng sự đã nghiên cứu tác dụng của apigenin đối với các kiểu hình giống tế bào gốc ung thư của các dòng tế bào u nguyên bào thần kinh đệm (GBM) ở người U87MG và U373MG. Apigenin ức chế khả năng tự đổi mới, tăng trưởng tế bào và khả năng tạo dòng vô tính, cũng như khả năng xâm lấn của các tế bào giống tế bào gốc GBM. Apigenin ức chế kiểu hình giống tế bào gốc GBM thông qua việc điều hòa giảm con đường tín hiệu c-Met. Nó chặn sự phosphoryl hóa của c-Met và các chất kích thích hạ nguồn của nó và làm giảm mức độ biểu hiện của các dấu hiệu tế bào gốc như CD133, Nanog và Sox2.
Apigenin cũng được báo cáo là làm tăng độ nhạy của tế bào gốc ung thư tuyến tiền liệt CD44+ ở người đối với liệu pháp cisplatin bằng cách ức chế tế bào gốc ung thư phổi. Sự kết hợp của apigenin và cisplatin đã tăng cường đáng kể tác dụng gây độc tế bào và apoptosis của cisplatin thông qua việc điều hòa giảm Bcl-2. Liệu pháp kết hợp ức chế sự phosphoryl hóa của PI3K và Akt, ức chế biểu hiện protein của NF-κB và điều hòa giảm chu kỳ tế bào bằng cách điều hòa tăng p21, cũng như các kinase phụ thuộc cyclin CDK-2, -4 và -6. Apigenin cũng làm tăng tác dụng ức chế của cisplatin đối với sự di chuyển của tế bào thông qua việc điều hòa giảm biểu hiện của Snail.
Các Flavonoid khác ảnh hưởng đến CSC: Wogonin là một flavone O-methylated có đặc tính chống ung thư được tìm thấy trong Scutellaria baicalensis. Đây là một loại thuốc nổi tiếng được sử dụng cho nhiều loại ung thư khác nhau, bao gồm ung thư biểu mô tế bào gan, ung thư biểu mô phổi và u nguyên bào thần kinh đệm. Wogonin gây ra apoptosis trong CSC của tế bào ung thư xương người (tế bào ung thư xương dương tính với CD133), ức chế khả năng di động của nó trong ống nghiệm thông qua việc điều hòa giảm biểu hiện của MMP-9 và ngăn chặn khả năng tự đổi mới của nó. Hơn nữa, một nghiên cứu in vitro cho thấy wogonin thể hiện chức năng ức chế đối với tế bào gốc ung thư xương. Wogonin ức chế sự biểu hiện của các gen liên quan đến tế bào gốc bằng cách điều chỉnh mức độ các loại oxy phản ứng (ROS) và tín hiệu liên quan đến ROS.
Genistein là một isoflavone tự nhiên, ức chế sự hình thành khối u và giảm biểu hiện Gli1 và CD44. Trong các mô hình dị ghép, genistein ức chế sự phát triển của khối u và điều hòa giảm biểu hiện của Gli1 và CD44 trong các mô khối u ở các tế bào ung thư tuyến tiền liệt kháng docetaxel và trong mô hình ung thư vú.
Myricetin là một flavonol được tìm thấy trong quả mọng, hành tây và nho đỏ. Myricetin thúc đẩy sự biệt hóa tạo xương của tế bào gốc dây chằng nha chu ở người thông qua việc điều hòa tăng hoạt động phosphatase kiềm (ALP) và biểu hiện của các yếu tố liên quan đến tạo xương thông qua các con đường BMP-2/Smad và ERK/JNK/p38 MAPK.
Epigallocatechin gallate (EGCG), được tìm thấy trong lá trà, được phát hiện là ức chế khả năng tự đổi mới của PCSC người thuộc quần thể CD44 + CD133 +. EGCG gây ra apoptosis bằng cách kích hoạt caspase-3/7 và ức chế sự biểu hiện của Bcl-2, survivin và XIAP trong CSC và ức chế sự di chuyển và xâm lấn của CSC. Điều thú vị là EGCG hiệp đồng với quercetin trong việc loại bỏ các đặc điểm của tế bào gốc ung thư. Hơn nữa, EGCG được phát hiện là điều hòa giảm biểu hiện của Gli1 và ức chế sự tăng sinh của một số loại tế bào ung thư. EGCG ức chế khả năng tự đổi mới của tế bào thông qua việc điều chỉnh các dấu hiệu tế bào gốc, Nanog, c-Myc và Oct4, cũng như các chất trung gian tín hiệu Hh, Smo, Ptch và Gli1/2. Trong mô hình động vật ung thư gan do chất gây ung thư, EGCG đã làm giảm quần thể tế bào dương tính với CD44 và ức chế biểu hiện của Gli1, Smo, cyclin D1, cMyc và EGFR.
Fisetin là một flavonol có nhiều trong tự nhiên trong nhiều loại trái cây và rau quả và có đặc tính chống khối u. Si và cộng sự đã kiểm tra tác dụng của nó đối với tế bào gốc ung thư thận ở người (HuRCSC) được phân lập từ các mẫu ung thư thận và phát hiện ra rằng fisetin ức chế sự tăng sinh bằng một cơ chế biểu sinh. Nó làm giảm đáng kể biểu hiện của protein chuyển vị mười-một (TET1), ức chế hiệu quả mức độ biến đổi 5-hydroxymethylcytosine (5hmC) tại các đảo CpG trong cyclin Y (CCNY) và CDK16, và làm giảm phiên mã và hoạt động của chúng, gây ra một chu kỳ tế bào bị bắt giữ.
Tabasum và cộng sự đã khám phá tác dụng chống di căn của fisetin trong các dòng tế bào ung thư phổi không phải tế bào nhỏ (NSCLC) A549 và H1299, nhấn mạnh vào quá trình chuyển đổi biểu mô thành trung mô (EMT). EMT thúc đẩy di căn bằng cách cho phép các tế bào khối u có được các đặc tính di chuyển và xâm lấn tăng lên, làm trung gian cho sự lan truyền của chúng đến các vị trí xa. Người ta thấy rằng fisetin ức chế đáng kể sự di chuyển và xâm lấn của các tế bào NSCLC dưới nồng độ không gây độc tế bào. Fisetin làm suy giảm EMT ở cả hai dòng tế bào với biểu hiện điều hòa tăng của các dấu hiệu biểu mô và điều hòa giảm của các dấu hiệu trung mô. Hơn nữa, điều trị bằng fisetin làm giảm các dấu hiệu đặc trưng của tế bào gốc NSCLC CD44 và CD133. Do đó, fisetin là một tác nhân trị liệu tiềm năng cho các tế bào gốc ung thư phổi.
Broussoflavonol B từ vỏ cây Dướng (broussonetia papyrifera), thể hiện hoạt tính ức chế tăng trưởng mạnh đối với các tế bào ung thư vú, làm nhạy cảm các tế bào gốc/tiền thân ung thư vú với tamoxifen và hạn chế sự tăng sinh của các tế bào giống tế bào gốc ung thư vú âm tính với ER.
Morusin, một flavonoid butenylated được phân lập từ vỏ rễ của Moraceae, cũng có khả năng nhắm mục tiêu vào CSC cổ tử cung bằng cách làm suy giảm hoạt động NF-kB.
Icaritin một dẫn xuất prenylflavonoid từ chi Epimedium, ức chế sự tăng trưởng của tế bào gốc ung thư gan thông qua việc điều hòa giảm hoạt động của STAT và ức chế sự tăng trưởng ác tính của các tế bào khởi đầu ung thư biểu mô tế bào gan (HCIC). Chất tương tự của nó, SNG1153, ức chế sự hình thành khối u và làm giảm các tế bào ung thư dương tính với CD133 (dấu hiệu CSC phổi). Nó cũng ức chế sự tăng trưởng của CSC phổi, có thể là một tác nhân trị liệu mới để điều trị ung thư phổi ở người. SNG1153 gây ra phosphoryl hóa β-catenin và điều hòa giảm β-catenin.
Casticin, có nguồn gốc từ Fructus Viticis Simplicifoliae, ức chế khả năng tự đổi mới của tế bào gốc ung thư gan từ dòng tế bào MHCC97, và β-catenin đã được xác định là mục tiêu tiềm năng.
6. Flavonoid nhắm mục tiêu ABCG2 trong CSC
Các chất vận chuyển ABC bao gồm 49 protein vận chuyển được phân loại thành bảy phân họ, ABCA đến ABCG, nằm trong màng tế bào và có các chức năng khác nhau. Bằng cách sử dụng ATP, các chất vận chuyển ABC hoạt động để vận chuyển các chất nền của chúng qua màng tế bào và bảo vệ tế bào chống lại các chất xenobiotic, bao gồm một số loại thuốc chống ung thư.
Tế bào gốc ung thư được biết là biểu hiện mức độ ABCG2 cao và do đó có đặc điểm kháng hóa trị đa thuốc. Những tế bào này được cho là dẫn đến tái phát sau khi hóa trị. Do đó, ức chế ABCG2 có thể có lợi ích bổ sung bên cạnh việc chống lại khả năng kháng đa thuốc, tiêu diệt chọn lọc CSC. Điều thú vị là, một số lượng ngày càng tăng các chất ức chế tyrosine kinase (TKI) được FDA phê duyệt, bao gồm imatinib và gefitinib, đã được báo cáo là điều hòa giảm hoặc bất hoạt ABCG2 và do đó, có thể đóng vai trò là ứng cử viên để đảo ngược khả năng kháng hóa trị của tế bào gốc ung thư. Tương tự, một số sản phẩm tự nhiên cũng được báo cáo là làm bất hoạt ABCG2 và do đó làm cho các tế bào gốc ung thư nhạy cảm với hoạt động của hóa trị tiêu chuẩn bao gồm các hợp chất estrogen; một số dẫn xuất tamoxifen ngoài phytoestrogen và flavonoid đã được chứng minh là có thể đảo ngược khả năng kháng thuốc do ABCG2 làm trung gian. Flavonoid dường như là chất ức chế ABCG2 đầy hứa hẹn, vì chúng thể hiện hoạt động chọn lọc và phổ rộng.
Các flavonoid silymarin, hesperetin, quercetin và daidzein đã được chứng minh là làm tăng sự tích tụ mitoxantrone nội bào trong các tế bào biểu hiện ABCG2. Các flavonoid như Chrysin và biochanin A được báo cáo là chất ức chế mạnh ABCG2 trong các tế bào ung thư vú và do đó có thể làm nhạy cảm các tế bào gốc ung thư vú với hoạt động hóa trị liệu ung thư như mitoxantrone. Điều thú vị là các flavonoid ức chế dường như không cạnh tranh hoặc cạnh tranh một phần đối với dòng chảy ra của mitoxantrone. Hầu hết các hợp chất không ức chế hoạt động ATPase trong ABCG2 và được giả định là không tự vận chuyển bởi chất vận chuyển.
Các nghiên cứu về hoạt động cấu trúc đã dẫn đến việc xác định các chất ức chế ABCG2 mới như 6-prenylchrysin thể hiện IC50 là 0,3 M. Tính độc tương đối thấp của 6-prenylchrysin và sự nhạy cảm hiệu quả của sự tăng trưởng tế bào đối với mitoxantrone đã làm cho các hợp chất này trở nên hứa hẹn để sử dụng tiềm năng trong tương lai trong các thử nghiệm lâm sàng.
Trong một nghiên cứu gần đây, tác dụng ức chế của flavonoid tự nhiên đối với ABCG2 có tương quan với tác dụng tích cực của chúng đối với dược động học của thuốc chống ung thư. Một bảng gồm 32 flavonoid đã được sàng lọc bằng cách sử dụng các xét nghiệm tích lũy và độc tính tế bào topotecan, và dẫn đến việc xác định 3′,4′,7-trimethoxyflavone là chất ức chế mạnh nhất của ABCG2.
Người ta thấy rằng nhiều sự kết hợp flavonoid gây ra sự ức chế ABCG2 mạnh mẽ bằng cách tăng cả sự tích lũy và độc tính tế bào của mitoxanthrone trong các tế bào ung thư vú biểu hiện quá mức ABCG2. Các ứng cử viên tốt nhất là biochanin A (isoflavone), kaempferide (flavonol), 5,7-dimethoxyflavone và 8-methylflavone.
Chalcones, cũng thuộc họ flavonoid và là hợp chất tự nhiên có trong thực vật ăn được, đã được phát hiện là ức chế ABCB1 và ABCG2 khác nhau, các chalcones cơ bản hoạt động hiệu quả hơn trên chất vận chuyển ABCB1 và chalcones không cơ bản trên các chất vận chuyển ABCG2. Chalcones thể hiện hoạt tính và độ chọn lọc cao nhất đối với ABCG2 được tìm thấy trong số các dẫn xuất được dimetoxyl hóa hoặc dihydroxyl hóa ở vòng A, bằng chứng là các xét nghiệm tích lũy và độc tính tế bào mitoxantrone.
7. Hoạt động chống CSC của Flavonoid qua trung gian điều chỉnh microRNA
MicroRNA (miRNA) là các phân tử RNA nội sinh ngắn (~17–28 nucleotide) điều chỉnh độ ổn định và dịch mã mRNA như một phần của phức hợp RISC, bằng cách liên kết với các vị trí cụ thể trong vùng 3′ không được dịch mã của mRNA thông qua phần bổ sung trình tự. Kể từ khi miRNA được phát hiện vào đầu thế kỷ này, sự tham gia của chúng vào nhiều quá trình sinh học khác nhau đã được mô tả và ước tính rằng sự biểu hiện của >60% tất cả các gen mã hóa protein được điều chỉnh bởi miRNA và tùy thuộc vào tiêu chí đưa vào, từ 600 đến 2000 miRNA được mã hóa trong bộ gen người.
Một trong những bối cảnh được nghiên cứu kỹ hơn về chức năng của miRNA là sinh học ung thư. Một nhóm miRNA đã được tìm thấy là được điều hòa tăng trong nhiều loại ung thư khác nhau, với mức độ cao hơn của chúng góp phần vào các khía cạnh khác nhau của quá trình sinh ung thư (do đó, chúng được mệnh danh là “oncomiRs”). Các miRNA khác đã được xác định là bị điều hòa giảm trong ung thư và hoạt động như các chất ức chế khối u. Cuối cùng, một số miRNA (chẳng hạn như miR-10b và miR-221/222) có thể hoạt động như cả chất ức chế khối u và oncomiR, dựa trên loại và giai đoạn ung thư, và tùy thuộc vào lựa chọn cụ thể và danh mục các gen mục tiêu được biểu hiện.
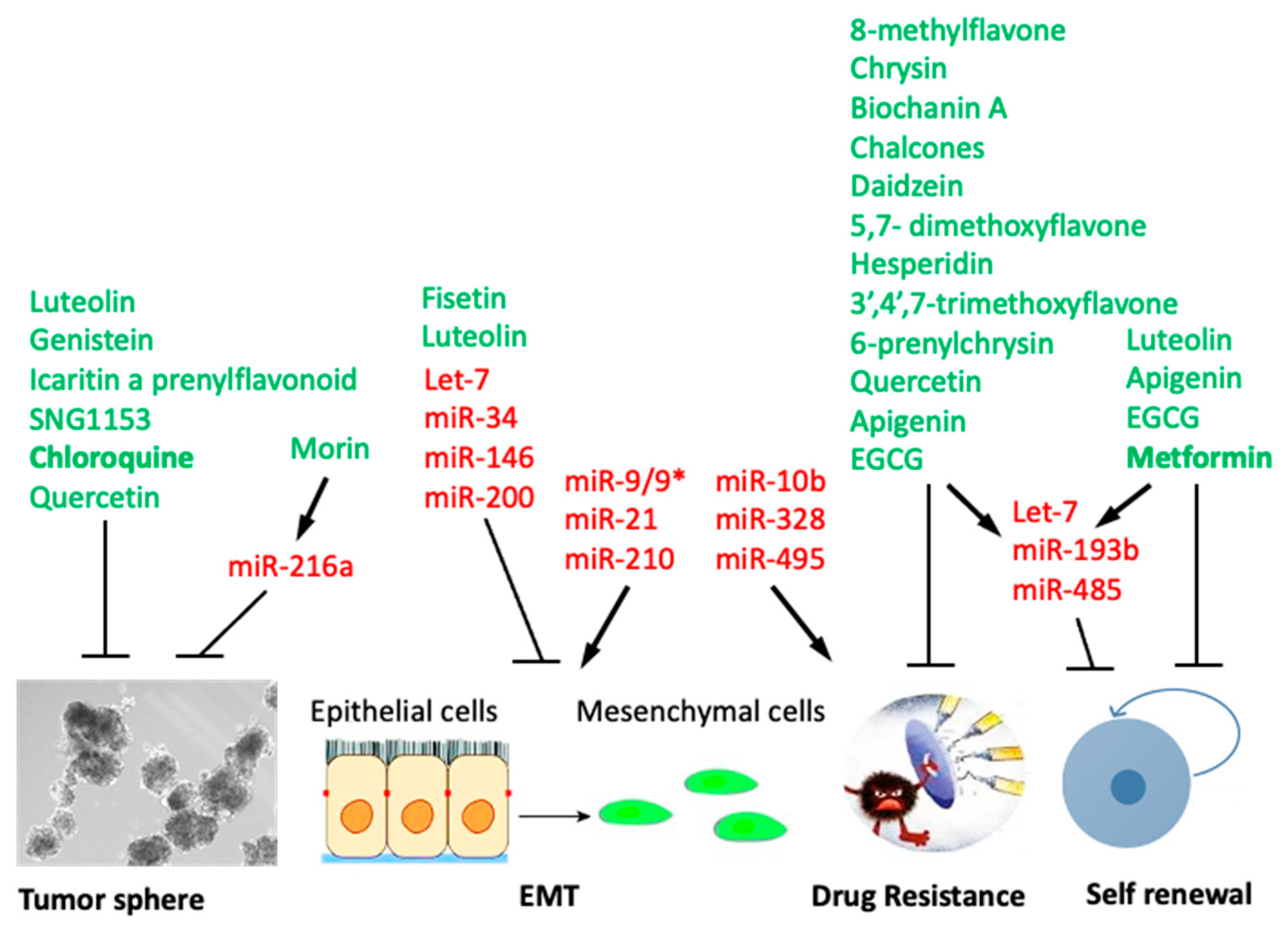
Một số miRNA đã được chứng minh là có chức năng duy trì tế bào gốc ung thư (CSC). Do đó, các họ miR-34, miR-199 và miR-200, cũng như miR-1, miR-143 và miR-146 đều đã được chứng minh là điều chỉnh các yếu tố của đường dẫn Notch, đóng vai trò trung tâm trong CSC. Các miRNA khác có liên quan đến việc điều chỉnh EMT, trong số đó có miR-106b, miR-22 và miR-203. miR-9/9* và miR-21 đã được báo cáo là thúc đẩy kiểu hình CSC, trong khi miR-10b, miR-328 và miR-495 đã được chứng minh là thúc đẩy di căn và kháng thuốc của các tế bào. Họ Let-7 và miR-302 đã được báo cáo là có liên quan đến sự biệt hóa CSC. Ngoài ra, một số gen ức chế khối u (ví dụ: let-7, miR-34, miR-146, miR-200) và oncomiRs (ví dụ: miR-21, miR-210) có liên quan đến tín hiệu các loại oxy phản ứng, có thể gây ra các đặc tính CSC và EMT.
Một số miRNA ức chế khối u đã biết là chất điều chỉnh trực tiếp sự biểu hiện của các protein đánh dấu CSC. Do đó, dựa trên thuật toán dự đoán TargetScan, gen PROM1 mã hóa peptide CD133 có một vị trí liên kết miR-200 được bảo tồn trong 3′UTR của nó, và mục tiêu đã được xác nhận trong mô hình tế bào hình bầu dục gan chuột. Tương tự, CD44 đã được báo cáo là được miR-221/222 điều chỉnh trực tiếp trong các tế bào tủy xương.
Tác động của Flavonoid lên Micrornas: Một số nghiên cứu đã kiểm tra tác động của việc tiếp xúc với flavonoid lên mức độ của các miRNA cụ thể và các mục tiêu hạ nguồn của chúng. Do đó, nhóm Koike đã báo cáo rằng điều trị bằng flavonoid apigenin ức chế sự biểu hiện quá mức ngoại sinh của miR-103 ở chuột, dẫn đến cải thiện khả năng dung nạp glucose. Cùng một nhóm cũng đã báo cáo rằng điều trị apigenin ức chế mức miR-122 trong ống nghiệm, có thể thông qua một cơ chế liên quan đến phosphoryl hóa TRBP. Mặc dù nghiên cứu cụ thể đó tập trung vào vai trò của miR-122 trong nhiễm HCV, nhưng vai trò ức chế khối u trước đây đã được báo cáo cho miRNA này.
Khả năng của flavonoid ảnh hưởng đến miRNA liên quan đến quá trình sinh ung thư đặc biệt liên quan đến CSC. Do đó, trong các tế bào ung thư vú, tiếp xúc với Glabridin, một hóa chất thực vật từ rễ của Glycyrrhiza glabra, đã điều hòa tăng miR-148a thông qua quá trình de-methyl hóa promoter, dẫn đến sự ức chế SMAD2 và giảm các đặc tính giống CSC. Sự suy giảm này đã được quan sát thấy cả trong ống nghiệm, tức là trong các dòng tế bào ung thư vú MDA-MB-231 và Hs-578T, và trong các mô hình dị ghép chuột. Sự điều hòa tăng của miR-148 trong các dòng tế bào ung thư vú bởi Glabridin cũng ức chế con đường tín hiệu Wnt/β-catenin, dẫn đến giảm sự hình thành mạch.
Trong ung thư phổi không phải tế bào nhỏ, EGCG, tăng cường mức độ mir-485-5p, ức chế mức độ của hai mục tiêu gây ung thư, CD44 và thụ thể hạt nhân RXRα, cả hai tác dụng này đều góp phần làm giảm các đặc tính giống CSC. Các chất ức chế miR-485 làm tăng kiểu hình giống CSC, có thể được đảo ngược bằng liều EGCG đã chỉ định; liên kết này cũng đã được thử nghiệm trong cơ thể. Cuối cùng, trong các dòng tế bào ung thư biểu mô ống tuyến tụy, sự kết hợp của các phương pháp điều trị sulforaphane, quercetin và catechin (bao gồm cả EGCG) đã dẫn đến sự điều hòa tăng của miRNA let-7 và giảm các đặc tính tự đổi mới giống CSC. Quercetin cũng gây ra miR-200b-3p, làm giảm tín hiệu Notch, thúc đẩy sự bất đối xứng của tế bào con và ức chế khả năng tự đổi mới trong các tế bào ung thư tuyến tụy.
Trong các tế bào u ác tính CD133+, điều trị bằng Morin đã gây ra miR-216a. Khi được thực hiện trong ống nghiệm, điều này dẫn đến việc giảm khả năng sống của tế bào, hình thành khối cầu và biểu hiện của các gen đánh dấu tế bào gốc CD20, CD44, CD133 và Wnt-3A. Điều này cũng đã được quan sát thấy trong cơ thể: một mô hình dị ghép u ác tính được điều trị bằng Morin cho thấy kích thước và trọng lượng khối u giảm, cũng như giảm biểu hiện của các dấu hiệu tế bào gốc và Wnt-3A.
Các hợp chất tự nhiên không độc hại đã cho thấy hứa hẹn như một phương pháp bổ sung cho hóa trị liệu thông thường, trong việc ức chế CSC bằng cách nhắm mục tiêu miRNA. Do đó, điều trị bằng resveratrol hoặc chất tương tự pterostilbene của nó làm tăng biểu hiện và hoạt động của Argonaute2, làm tăng biểu hiện của một số miRNA ức chế khối u, ví dụ: miR-16, -141, -143 và -200c, và dẫn đến sự ức chế lâu dài các mục tiêu của chúng trong ung thư vú. Những phát hiện phù hợp nhất được tóm tắt trong Bảng 2 và tóm tắt bằng đồ họa xuất hiện trong Hình 2.

Với sự tham gia phổ biến của miRNA trong các con đường truyền tín hiệu ảnh hưởng đến CSC, thật hợp lý khi cho rằng tác dụng của flavonoid đối với CSC là qua trung gian, bởi miRNA và các miRNA này là mục tiêu tiềm năng để can thiệp điều trị bổ sung.
8. Thuốc được FDA phê duyệt dựa trên các sản phẩm tự nhiên điều chỉnh CSCs
Bản thảo hiện tại tập trung vào hoạt động chống CSC của flavonoid. Tuy nhiên, không có flavonoid nào có hoạt tính chống CSC được FDA chấp thuận. Vì vậy, chúng tôi sẽ thảo luận về các loại thuốc được FDA phê chuẩn có nguồn gốc thực vật thể hiện hoạt tính chống CSC. Trong số đó, chúng tôi chọn tập trung vào Chloroquine (CQ) và metformin.
Chloroquine (CQ): CQ được phân lập từ vỏ cây Canhkina (cinchona Officinalis) và là một loại thuốc được FDA chấp thuận để điều trị và phòng ngừa bệnh sốt rét. CQ là một thành viên của nhóm thuốc 4-aminoquinoline. Hiện nay, nó cũng đang được nghiên cứu như một phương pháp điều trị chống lại COVID-19. CQ có chức năng như một chất ức chế autophagy. Dữ liệu gần đây chỉ ra rằng khả năng kháng hóa trị trong ung thư biểu mô buồng trứng (EOC) có liên quan đến việc kích hoạt autophagy. CSC được phân lập từ dịch báng EOC biểu hiện autophagy cơ bản cao hơn so với đối tác không phải tế bào gốc. Ức chế con đường này, bằng cách xử lý CQ ex vivo hoặc CRISPR / Cas9 ATG5 knockout, làm suy yếu khả năng sống của CSC và khả năng hình thành khối u trong ống nghiệm, và làm giảm đáng kể khả năng gây ung thư trong cơ thể sống. Ngoài ra, ức chế autophagy cho thấy tác dụng hiệp đồng với việc sử dụng carboplatin đối với cả các đặc tính CSC trong ống nghiệm và hoạt động gây ung thư trong cơ thể sống. CQ cũng có hiệu quả trong việc gây tổn thương cấu trúc ty thể và ức chế autophagy trong CSC từ BC âm tính ba (TNBC). CQ làm giảm hiệu quả khả năng di căn của các tế bào TNBC trong ống nghiệm và trong mô hình dị ghép TNBC. Do đó, vì TNBC được làm giàu cao với CSC, CQ có thể là một bổ sung hiệu quả cho carboplatin để điều trị hiệu quả. Các báo cáo bổ sung cho thấy CQ làm nhạy cảm các tế bào CSC TNBC với paclitaxel thông qua việc ức chế autophagy và làm giảm quần thể CSC CD44 (+) / CD24 (-) trong cả môi trường tiền lâm sàng và lâm sàng. Một số cơ chế phân tử có liên quan đến chức năng trung gian của CQ. Choi và cộng sự đã báo cáo rằng CQ điều chỉnh CSC trong TNBC thông qua việc ức chế chất truyền tín hiệu và hoạt hóa phiên mã 3 (STAT3) của kinase 2 (Jak2) được kích hoạt Janus bằng cách giảm biểu hiện của Jak2 và DNA methyltransferase 1 (DNMT1). Các báo cáo khác đã chứng minh rằng CQ có tác dụng chống CSC đối với ung thư tuyến tụy CSC bằng cách ức chế tín hiệu CXCL12 / CXCR4, dẫn đến giảm phosphoryl hóa ERK và STAT3. Hơn nữa, CQ cho thấy sự ức chế mạnh mẽ tín hiệu hedgehog bằng cách giảm sản xuất Smoothened, chuyển thành giảm đáng kể quá trình hóa hướng do sonic hedgehog gây ra và điều hòa giảm các mục tiêu hạ nguồn trong CSC và chất nền xung quanh. Do đó, CQ là một liệu pháp bổ trợ hiệu quả cho hóa trị, thể hiện hoạt động chống CSC và ý nghĩa lâm sàng của thuốc này cần được khám phá thêm trong môi trường lâm sàng.
Metformin: Metformin (MET, N′-dimethyl biguanide) được tổng hợp lần đầu tiên vào những năm 1920 từ guanidine có nguồn gốc từ cây tử đinh hương Pháp (Galega officinalis L.) và là một trong những loại thuốc chống tăng đường huyết đường uống được sử dụng phổ biến nhất trong điều trị bệnh tiểu đường loại 2 , đặc biệt là ở những người thừa cân. Metformin ức chế quá trình tân tạo đường, làm giảm lượng đường trong máu, tăng độ nhạy insulin và giảm tình trạng tăng insulin máu. Cơ chế hoạt động của metformin liên quan đến các con đường tín hiệu phụ thuộc AMP-activated protein kinase (AMPK) và không phụ thuộc AMPK.
Metformin được báo cáo là có tác dụng chống ung thư, đặc biệt là chống lại các tế bào gốc ung thư (CSC), bao gồm cả tế bào gốc ung thư vú (BC). Metformin ức chế khả năng tự đổi mới và tính gốc, đồng thời làm giảm tỷ lệ tế bào trong giai đoạn S. CSC BC đặc biệt nhạy cảm với metformin, chất này gây ra chết tế bào nhanh chóng được tạo điều kiện thông qua một số con đường bao gồm Notch 1, NF-κB, Sox2, KLF-4, Oct4, Lin28, MMP-9 và MMP-2. Hơn nữa, metformin làm trung gian cho hoạt động của nó chống lại CSC thông qua việc điều chỉnh nhiều miRNA, bao gồm let-7 và miR-193b. Điều thú vị là trong số các phân nhóm BC phân tử, TNBC cho thấy sự phong phú cao nhất của CSC, cho thấy độ nhạy cao với metformin.
Kết hợp với hóa trị, metformin đặc biệt hoạt động chống lại CSC BC. Trong các nghiên cứu về các tế bào BC kháng trastuzumab cũng như các mô hình dị ghép, sự kết hợp của trastuzumab và metformin làm giảm đáng kể các phân nhóm CSC và giảm thể tích khối u . Kết hợp với doxorubicin, paclitaxel hoặc carboplatin, metformin cũng có thể loại bỏ CSC và giảm liều lượng hiệu quả cần thiết của các tác nhân hóa trị, giảm thiểu độc tính tiềm ẩn cho các cơ quan.
Dữ liệu dịch tễ học cho thấy nguy cơ ung thư giảm đáng kể ở những bệnh nhân rối loạn chuyển hóa dùng metformin. Việc sử dụng metformin của bệnh nhân BC cũng có liên quan đến việc cải thiện đáp ứng điều trị và khả năng sống sót. Trong một nghiên cứu phân tích tổng hợp về bệnh nhân BC mắc bệnh tiểu đường, việc sử dụng metformin có liên quan đến việc cải thiện 65% khả năng sống sót đặc hiệu BC so với những người không sử dụng. Các đặc tính chống ung thư của metformin trái ngược với các thuốc chống đái tháo đường khác, bao gồm sulfonylurea và insulin, thúc đẩy sự phát triển của ung thư.
Hoạt động chống ung thư của metformin đã được khám phá trong các phòng khám như một lựa chọn trị liệu bổ trợ để kiểm soát BC. Các thử nghiệm lâm sàng đã chỉ ra rằng metformin cải thiện kết quả cho bệnh nhân BC mắc bệnh tiểu đường. Đáng chú ý, TNBC, thường là loại tích cực nhất và ít đáp ứng với hóa trị truyền thống, đặc biệt nhạy cảm với metformin.
Hoạt động lâm sàng của metformin không giới hạn ở bệnh nhân BC tiểu đường, vì bệnh nhân BC không tiểu đường cũng được đánh giá với kết quả đầy hứa hẹn. Một phân tích tổng hợp các nghiên cứu liên quan đến liệu pháp metformin ở bệnh nhân không mắc bệnh tiểu đường và bệnh nhân BC mắc bệnh tiểu đường được trình bày trong. Nhiều thử nghiệm lâm sàng hiện đang được tiến hành ở bệnh nhân BC và các loại ung thư khác để đánh giá lợi ích của metformin kết hợp với hoặc sau khi sử dụng các tác nhân trị liệu khác.
9. Kết luận và triển vọng trong tương lai
Sự tồn tại của tế bào gốc ung thư và sự liên quan của chúng đến khả năng kháng thuốc hóa trị và tái phát bệnh đã được ghi nhận rõ ràng. Sự hiểu biết này sẽ dẫn đến những thay đổi trong chiến lược điều trị ung thư, bao gồm các phương tiện để loại bỏ tế bào gốc ung thư nhằm đạt được đáp ứng lâu dài. Điều này có thể đạt được bằng cách phát triển các liệu pháp chống CSC hiệu quả sẽ được kết hợp với các liệu pháp chống ung thư hiện có. Flavonoid tự nhiên hoặc các dẫn xuất mạnh là những ứng cử viên tốt trong việc thể hiện hoạt động chống CSC và nhắm mục tiêu các chức năng quan trọng cần thiết cho sự sống còn của CSC (Hình 3). Mặc dù tiềm năng đầy hứa hẹn của flavonoid, nhưng một thực tế đã biết là số lượng nhược điểm hạn chế việc sử dụng đầy đủ flavonoid trong điều trị như thiếu tính chọn lọc, hiệu lực kém và sinh khả dụng. Việc khắc phục những hạn chế trên có thể thực hiện được bằng cách tổng hợp các dẫn xuất với các đặc tính được cải thiện. Các con đường để cải thiện khả năng tiếp cận sinh học và sinh khả dụng của flavonoid có thể bao gồm tăng hấp thu ở ruột , cải thiện độ ổn định trao đổi chất hoặc thay đổi vị trí hấp thụ (từ ruột kết đến ruột non). Để đạt được những mục tiêu này, hệ thống phân phối vi nang, nhũ tương / nanoemulsion, hạt nano lipid rắn, liposome / nanoliposome, methyl hóa enzym và các công nghệ thân thiện với người tiêu dùng khác là cần thiết. Những phát triển trong tương lai có thể bao gồm việc phát triển các phân tử lưỡng mô-đun (lai), dẫn đến liệu pháp hiệu quả và lâu dài hơn. Một thách thức khác là dự đoán các tương tác thuốc – flavonoid có hại. Ngoài ra, cần đánh giá nguy cơ gia tăng tác dụng phụ do sử dụng các chất ức chế chống CSC giả định kết hợp với các liệu pháp điều trị ung thư khác.
Trả lời