Xiaocheng Cao, Hui Zou, Jianguo Cao, Yinghong Cui, Shuwen Sun, Kaiqun Ren, Zhenwei Song, Duo Li, Meifang Quan
Biên dịch: Hoàng Đôn Hòa | Viện Y học bản địa Việt Nam
Bối cảnh:
Tế bào gốc ung thư (CSCs) được coi là nguyên nhân gây tái phát khối u. Nghiên cứu này nhằm mục đích điều tra tác động của tổng flavonoid từ Fructus Viticis (FVTF) lên các đặc tính của tế bào gốc ung thư phổi (LCSLCs) có nguồn gốc từ dòng tế bào ung thư phổi tế bào nhỏ ở người NCI-H446 và cơ chế tiềm năng của nó.
Phương pháp:
Dòng tế bào ung thư phổi tế bào nhỏ ở người NCI-H446 được nuôi cấy in vitro. Các tế bào CD133+ được phân loại từ dòng tế bào NCI-H446 bằng phương pháp tách từ tính.
Nuôi cấy lơ lửng với môi trường điều hòa tế bào gốc được sử dụng để khuếch đại các tế bào tạo khối cầu CD133+ (SFCs). Các đặc tính tế bào gốc của CD133+ SFCs được đánh giá bằng khả năng tự làm mới tế bào thông qua xét nghiệm tạo khối cầu, khả năng di chuyển và xâm lấn bằng xét nghiệm Transwell, khả năng tạo khối u bằng mô hình dị ghép trên chuột nude và mức độ biểu hiện của các dấu ấn tế bào gốc ung thư bằng phương pháp Western blot. Tác động của FVTF lên các đặc tính của LCSLCs được kiểm tra bằng xét nghiệm tạo khối cầu và xét nghiệm buồng Transwell. Mức độ biểu hiện của p-Akt được xác định bằng phân tích Western blot.
Kết quả:
Các tế bào CD133+ SFCs có nguồn gốc từ tế bào ung thư phổi tế bào nhỏ ở người NCI-H446 thể hiện các đặc tính gốc của sự hình thành khối cầu và khả năng tạo khối u so với các tế bào gốc. FVTF tương đối ức chế chọn lọc sự tăng sinh của LCSLCs, ngăn chặn khả năng hình thành khối cầu và di chuyển cũng như xâm lấn của LCSLCs, và điều hòa giảm biểu hiện protein của các dấu ấn tế bào gốc (CD133, CD44 và ALDH1), các yếu tố phiên mã liên quan đến tự làm mới (Bmi1, Nanog và OCT4) và các yếu tố phiên mã liên quan đến xâm lấn (Twist1 và Snail1) một cách phụ thuộc vào liều lượng. Hơn nữa, chúng tôi nhận thấy rằng việc điều trị FVTF có thể làm giảm đáng kể mức độ phosphoryl hóa của Akt trong LCSLCs. Trong khi đó, LY294002 và FVTF hiệp đồng ức chế các đặc tính của LCSLCs.
Kết luận:
FVTF ức chế các đặc tính của LCSLCs thông qua việc điều hòa giảm biểu hiện của p-Akt.
___________________________________________________
Ung thư phổi là một trong những bệnh ung thư phổ biến nhất trên toàn thế giới và là nguyên nhân gây tử vong do ung thư hàng đầu, đặc biệt ở các khu vực thành thị của Trung Quốc. Các phân loại phổ biến nhất của ung thư phổi là ung thư phổi không tế bào nhỏ (NSCLC) và ung thư phổi tế bào nhỏ (SCLC). Trong đó, SCLC là dạng ung thư phổi xâm lấn nhất, có khả năng xâm lấn cao và có xu hướng di căn sớm. Mặc dù có nhiều phác đồ điều trị thông thường được áp dụng trong lâm sàng, tỷ lệ sống sót sau 5 năm của ung thư phổi vẫn rất thấp do các phương pháp điều trị hiện tại thất bại và cuối cùng dẫn đến tái phát bệnh.
Các nhà nghiên cứu thường cho rằng khả năng kháng trị liệu của ung thư phổi là do các tế bào gốc ung thư (CSCs) trong khối u. Ngày càng có nhiều bằng chứng cho thấy nhiều loại ung thư rắn, bao gồm cả ung thư phổi, có nguồn gốc và được duy trì bởi một phân nhóm nhỏ CSCs. Những tế bào này có khả năng tự làm mới, biệt hóa và khởi tạo khối u liên tục cũng như khả năng kháng bức xạ và hóa trị tăng lên. CSCs được coi là nguồn gốc của sự tái phát khối u.
Gần đây, nhiều phương pháp khác nhau dựa trên các dấu hiệu bề mặt tế bào cụ thể, khả năng loại trừ thuốc nhuộm thấm màng tế bào hoặc khả năng hình thành khối cầu của tế bào đơn lẻ trong môi trường không huyết thanh đã được sử dụng để phân lập và đặc trưng CSCs. Tương tự như các khối u rắn khác, một số dấu ấn bề mặt giả định cho tế bào gốc ung thư phổi (LCSC) đã được xác định, bao gồm CD133 và CD44. Eramo và cộng sự lần đầu tiên phát hiện ra sự tồn tại của một quần thể tế bào biệt hóa thấp biểu hiện CD133 trong ung thư phổi tế bào nhỏ và không tế bào nhỏ. Những quần thể nhỏ tế bào sinh khối u CD133+ có khả năng tự làm mới và tạo ra một dòng vô hạn các tế bào khối u biệt hóa được gọi là tế bào gốc ung thư phổi (LCSC). Tuy nhiên, một nghiên cứu khác của Meng và cộng sự. phát hiện ra rằng cả hai quần thể phụ CD133+ và CD133- từ tế bào SCLC đều chứa số lượng tế bào gốc ung thư tương tự nhau, điều này cho thấy rằng CD133 không thể được sử dụng làm dấu hiệu tế bào gốc cho SCLC. Ngoài ra, Jiang và cộng sự cũng đã chứng minh rằng Aldehyde dehydrogenase 1 (ALDH1) là một dấu hiệu liên quan đến tế bào gốc khối u trong ung thư phổi. Tóm lại, mặc dù chưa xác định được dấu ấn tế bào cụ thể nào cho LCSC, nhưng chúng tôi cho rằng việc nuôi cấy lơ lửng với môi trường điều hòa tế bào gốc ít nhất có thể được sử dụng như một phương pháp tiếp cận quan trọng để làm giàu LCSC. Do đó, việc phát triển các tác nhân hóa trị mới có thể nhắm mục tiêu vào các LCSC này có ý nghĩa sâu sắc đối với công tác phòng ngừa và điều trị hóa chất ung thư.
Manjingzi (Fructus Viticis) là quả chín phơi khô của cây Vitex trifolia L. (họ Cỏ Roi Ngựa), một loại thuốc truyền thống của Trung Quốc sở hữu nhiều hoạt tính dược lý. Manjingzi chứa một lượng lớn flavonoid, bao gồm casticin, luteolin, apigenin, isoorientin, hesperidin, isovitexin, v.v.. Nhiều nghiên cứu đã chứng minh đặc tính chống khối u của các flavonoid này trên nhiều dòng tế bào ung thư ở người và mô hình dị ghép trên chuột. FVTF (Tổng Flavonoid Fructus Viticis), một sáng chế độc lập của phòng thí nghiệm chúng tôi, là một chế phẩm thuốc y học cổ truyền Trung Quốc chiết xuất từ Manjingzi (Đơn đăng ký sáng chế quốc gia số ZL 201210591146.9).
Trong nghiên cứu này, chúng tôi đã thu được các tế bào tạo khối cầu CD133+ (SFCs) từ các tế bào NCI-H446 bằng cách sử dụng phương pháp tách từ tính CD133+ và phương pháp nuôi cấy môi trường điều hòa tế bào gốc. Hơn nữa, chúng tôi đã xác nhận đặc tính LCSLC của SFCs bằng cách so sánh khả năng tự làm mới, mức độ biểu hiện của các dấu hiệu tế bào gốc và khả năng gây khối u của SFCs và các tế bào không phân loại, cụ thể là các tế bào gốc. Mục đích của nghiên cứu này là để điều tra xem FVTF có thể ức chế các đặc tính của LCSLCs hay không và các cơ chế tiềm năng liên quan.
PHƯƠNG PHÁP
Thuốc và thuốc thử
Fructus Viticis được mua từ Công ty Dược phẩm Ngọc Linh Trung Quý (Ngọc Linh, tỉnh Quảng Tây, Trung Quốc). Giáo sư Bing-Qing Zhao (Khoa Dược, Trường Cao đẳng Y tế Đại học Sư phạm Hồ Nam) đã xác định các mẫu vật. Một mẫu vật chứng đã được lưu trữ tại Khoa Dược, Trường Cao đẳng Y tế Đại học Sư phạm Hồ Nam (Số MJZ-001). Tổng flavonoid của Fructus Viticis (FVTF) được chiết xuất và điều chế từ Fructus Viticis theo thông số kỹ thuật bằng sáng chế (Đơn đăng ký sáng chế quốc gia Trung Quốc số ZL 201210591146.9), có dạng bột màu nâu. Lượng flavonoid tổng đo được trong FVTF sấy khô là 53% được tính dựa trên rutin.
Môi trường DMEM (Glucose cao), môi trường DMEM/F12, huyết thanh thai bò, trypsin 0,25% (chứa EDTA) và dung dịch đệm phosphate (PBS) được mua từ Hyclone (Logan, UT, USA). Yếu tố tăng trưởng nguyên bào sợi người tái tổ hợp (bFGF), yếu tố tăng trưởng biểu bì (EGF) và B27 được mua từ eBioscience. Bộ nhuộm Hematoxylin và Eosin, Matrigel (BD Biosciences, Hoa Kỳ). Dung dịch đệm ly giải tế bào, trypan blue, penicillin và streptomycin (Invitrogen Life Technologies) và albumin huyết thanh bò được mua từ Công ty TNHH Công nghệ Sinh học Hồ Nam Clonetimes (Trường Sa, Hồ Nam). Insulin của người được mua từ Công ty TNHH Công nghệ sinh học Bắc Kinh Định Quốc Trường Sinh. Các kháng thể đơn dòng chuột kháng CD44, ALDH1, Bmi1, Nanog, Oct4, Twist, Snail, p-Akt (Ser473), Akt, β-actin được mua từ Cell Signaling Technology (Beverly, MA, Hoa Kỳ).
Nuôi cấy tế bào
Dòng tế bào ung thư phổi tế bào nhỏ (SCLC) ở người NCI-H446 được mua từ Công ty Công nghệ sinh học Keygen (Nam Kinh, Trung Quốc) và được duy trì trong DMEM (Glucose cao) bổ sung 10% huyết thanh thai bò, 100 U/mL penicillin và 100 μg/mL streptomycin trong tủ ấm chứa 5% CO2 ở 37 °C.
Phân tách tế bào CD133+ bằng kỹ thuật tách từ tính
Các tế bào dương tính với CD133+ được phân loại từ dòng tế bào NCI-H446 bằng kỹ thuật tách từ tính (Miltenyi Biotec, Đức) theo hướng dẫn của nhà sản xuất. Tóm lại, đầu tiên, huyền phù tế bào đơn được chuẩn bị và số lượng tế bào được xác định trước khi đánh dấu từ tính. Các tế bào được thu thập bằng cách ly tâm ở tốc độ 300 × g trong 10 phút và viên tế bào được tái huyền phù trong 60 μL dung dịch đệm trên 107 tổng số tế bào. 20 μL Thuốc thử Chặn FcR và Hạt Vi mô CD133 đã được thêm vào mỗi 107 tổng số tế bào, tương ứng. Sau khi trộn đều và ủ ở 2-8 °C trong 15 phút, các tế bào được rửa và tái huyền phù tới 107 tế bào trong 500 μL dung dịch đệm. Huyền phù tế bào cuối cùng được áp dụng lên Cột MACS và các tế bào không được đánh dấu (CD133-) và các tế bào được đánh dấu từ tính (CD133 +) được thu thập tương ứng. Sau đó, các tế bào CD133+ được phân loại được gieo vào các đĩa 6 giếng có độ bám dính cực thấp (Corning Inc., NY, USA) để nuôi cấy khuếch đại với môi trường điều hòa tế bào gốc.
Phân tích tế bào dòng chảy
Các tế bào CD133+ được phân loại, các tế bào CD133- và các tế bào NCI-H446 gốc không được phân loại được rửa bằng PBS và được điều chỉnh thành huyền phù tế bào đơn ở mật độ 1 × 105 tế bào/mL, tương ứng. Các tế bào được ủ với kháng thể kháng CD133 của người liên hợp PE (Biolegend, San Diego, CA, Hoa Kỳ) trong 30 phút ở 4 °C trong bóng tối và IgG2b-PE của chuột được sử dụng làm đối chứng đồng vị. Cuối cùng, huyền phù tế bào được áp dụng lên phân tích tế bào dòng chảy về tỷ lệ phần trăm của các tế bào CD133+.
Xét nghiệm tạo khối cầu khối u
Khả năng tự làm mới của tế bào được đánh giá bằng cách sử dụng nuôi cấy lơ lửng trong đĩa 6 giếng có độ bám dính cực thấp (Corning Inc., NY, USA) với môi trường điều hòa tế bào gốc. Huyền phù tế bào đơn được chuẩn bị với môi trường điều hòa tế bào gốc và được nạp vào các đĩa 6 giếng có độ bám dính cực thấp (2 × 103 tế bào/ml). Sau khi nuôi cấy trong 6 ngày, số lượng khối cầu khối u hình thành được đếm và chụp ảnh dưới kính hiển vi tương phản pha (Nikon Eclipse TE2000-S). Tỷ lệ hình thành khối cầu được tính là tổng số khối cầu hình thành/tổng số tế bào được cấy × 100%. Đối với thí nghiệm can thiệp thuốc, các nồng độ FTVF khác nhau đã được thêm vào môi trường trước khi tế bào được cấy. Đối với xét nghiệm tạo khối cầu thứ cấp, các khối cầu khối u có nguồn gốc từ tế bào NCI-H446 CD133+ được tiêu hóa và chuẩn bị thành các huyền phù tế bào đơn lẻ. Sau đó, các tế bào được gieo vào đĩa 6 giếng có độ bám dính cực thấp với mật độ 1 × 103 tế bào/mL và không có thuốc nào được thêm vào quy trình xét nghiệm tạo khối cầu thứ cấp.
Xét nghiệm MTT
Các tế bào NCI-H446 gốc và tế bào CD133+ SFCs được gieo vào đĩa 96 giếng đã được phủ trước 0,6% agarose với mật độ 5 × 10^3 tế bào/giếng. Quy trình cho xét nghiệm MTT và cách tính tỷ lệ ức chế tăng sinh tế bào tương đối đã được mô tả trước đây. Giá trị IC50 được tính toán bằng phần mềm Prism (GraphPad Software, San Diego, CA).
Xét nghiệm di chuyển và xâm lấn tế bào trong ống nghiệm
Các xét nghiệm di chuyển và xâm lấn được thực hiện bằng cách sử dụng các buồng Transwell 24 giếng không phủ hoặc phủ Matrigel (BD Biosciences, Hoa Kỳ) với màng polycarbonate lỗ chân lông 8,0 μm (Corning Coster, Cambridge, MA, USA) như đã mô tả trước đây. Tóm lại, 600 μL DMEM với 10% FBS đã được thêm vào đĩa nuôi cấy 24 giếng (buồng dưới). Sau đó, các buồng Transwell được đưa vào đĩa 24 giếng và các tế bào được tái huyền phù trong DMEM không có huyết thanh và yếu tố tăng trưởng và được đưa vào các buồng (1 × 10^4 tế bào/100 μl). Sau khi ủ ở 37 °C, các tế bào đã di chuyển hoặc xâm nhập vào bề mặt dưới của màng được cố định và nhuộm bằng hematoxylin-eosin hoặc Wright-Giemsa. Cuối cùng, các tế bào được nhuộm được chụp ảnh kỹ thuật số và đếm dưới kính hiển vi quang học (OLYMPUS IX51, Nhật Bản). Đối với thí nghiệm can thiệp bằng thuốc, các tế bào đã được xử lý trước với các nồng độ FTVF khác nhau trong 24 giờ trước khi thử nghiệm buồng transwell.
Phân tích Western Blot
Quy trình Western blot được thực hiện như mô tả trước đây. Các kháng thể chính sau đây đã được sử dụng: Kháng thể đơn dòng chuột kháng CD44, ALDH1, Bmi1, Nanog, Oct4, Twist, Snail, p-Akt (Ser473) và Akt. β-actin được sử dụng làm chất kiểm soát nội bộ. Các tín hiệu được phát hiện bằng Bộ dụng cụ phát quang hóa học tăng cường (Amersham Pharmacia Biotech Inc., Piscataway, NJ, Hoa Kỳ).
Xét nghiệm khả năng sinh khối u trên chuột trụi lông
Chuột Balb/c-nu đực SPF được lấy từ Công ty TNHH Động vật Thí nghiệm Hồ Nam Slac Jingda (Nhạc Dương, Hồ Nam). Tất cả các nghiên cứu trên động vật trong nghiên cứu này đều được thực hiện theo hướng dẫn nhân giống và sử dụng động vật thí nghiệm của Ủy ban Quản lý Động vật Thí nghiệm Hồ Nam sau khi được Ủy ban Đạo đức của Đại học Sư phạm Hồ Nam phê duyệt. 18 con chuột Balb/c-nu đực SPF được chia ngẫu nhiên thành ba nhóm (6 con/nhóm). Các tế bào CD133+ và tế bào gốc trong PBS được trộn theo tỷ lệ 1:1 với Matrigel (BD Biosciences, San Jose, CA) và được tiêm dưới da vào hai bên sườn của động vật, tương ứng. Số lượng tế bào được cấy vào ba nhóm lần lượt là 1 × 10^2, 1 × 10^3 và 1 × 10^4/chuột đối với CD133+ SFCs và 1 × 10^4, 1 × 10^5 và 1 × 10^6/chuột đối với tế bào gốc. Các động vật được duy trì theo hướng dẫn tiêu chuẩn trong khoảng 2 tháng để theo dõi sự xuất hiện khối u. Kích thước của các nốt khối u được đo bằng thước cặp và thể tích được tính bằng công thức V (mm3) = L (đường kính dài nhất) × W (đường kính ngắn nhất)^2 × 0,5. Khi kết thúc thí nghiệm, các khối u được cắt bỏ, cân và chia thành nhiều mảnh để cố định trong formalin đệm trung tính và nhúng parafin và cắt lát để đánh giá mô học thường quy bằng phương pháp nhuộm hematoxylin và eosin (H&E) hoặc để phân tích miễn dịch hóa mô của CD44 và CD133.
Kiểm tra miễn dịch mô học
Các mô khối u được ghép dị chủ được cố định trong formalin 10%, nhúng parafin và cắt lát để phân tích miễn dịch mô học. Đối với nhuộm miễn dịch mô học, các lát cắt đã được tách parafin được ủ với H2O2 3,3% trong 10 phút để ngăn chặn hoạt động của peroxidase nội sinh. Các lát cắt sau đó được chặn bằng Tris Buffered Saline (TBS) chứa 5% huyết thanh dê bình thường trong 30 phút. Sau khi ủ với các kháng thể chính tương ứng được pha loãng (1:200 đối với kháng thể kháng CD133 của chuột và 1:250 đối với kháng thể kháng CD44 của chuột) và kháng thể thứ cấp, các tín hiệu được phát hiện bằng hệ thống EnVision (Dako, Carpinteria, CA, USA) và nhuộm lại bằng hematoxylin.
Phân tích thống kê
Kết quả được hiển thị dưới dạng trung bình ± SD. Phân tích phương sai được thực hiện bằng phần mềm SPSS 15.0 cho Windows sử dụng ANOVA một chiều và so sánh cặp đôi bằng t-test. P < 0,05 được coi là có ý nghĩa thống kê.
Kết quả
Tách tế bào CD133+ khỏi dòng tế bào NCI-H446 bằng phương pháp tách từ tính
Các tế bào NCI-H446 tăng sinh phụ thuộc vào bề mặt trong môi trường DMEM bổ sung 10% huyết thanh bào thai bò. Sau khi phân loại bằng hệ thống tách hạt vi mô CD133, tỷ lệ phần trăm của các tế bào biểu hiện CD133 trong các tế bào gốc không phân loại, các tế bào CD133+ và CD133- đã được kiểm tra bằng phân tích tế bào dòng chảy. Kết quả cho thấy tỷ lệ phần trăm của các tế bào biểu hiện CD133 lần lượt là 91,85 ± 2,17%, 0,03 ± 0,01% và 1,71 ± 0,29% trong các tế bào CD133+, CD133- và tế bào gốc (Hình 1). Các tế bào CD133+ được phân loại có nguồn gốc từ dòng tế bào NCI-H446 được nuôi cấy thêm để khuếch đại trong môi trường điều hòa tế bào gốc. Và các CD133+ SFCs được tạo ra đã được sử dụng cho thí nghiệm tiếp theo.

CD133+ SFCs từ dòng tế bào NCI-H446 thể hiện các đặc điểm của tế bào gốc ung thư phổi
Hình 2a cho thấy tỷ lệ hình thành khối cầu của CD133+ SFCs cao hơn nhiều so với tế bào gốc. Hơn nữa, Hình 2b cho thấy các tế bào đơn lẻ phân ly từ CD133+ SFCs có thể tiếp tục hình thành các khối u thứ cấp. Những kết quả này cho thấy CD133+ SFCs sở hữu khả năng tự làm mới mạnh mẽ hơn. Phù hợp với những phát hiện này, phương pháp Western blotting cho thấy mức độ biểu hiện của các yếu tố phiên mã liên quan đến tự làm mới (Bmi1, Nanog và Oct4) và các dấu hiệu tế bào gốc (CD44 và ALDH1) trong CD133+ SFCs cao hơn nhiều so với tế bào gốc (Hình 2c).
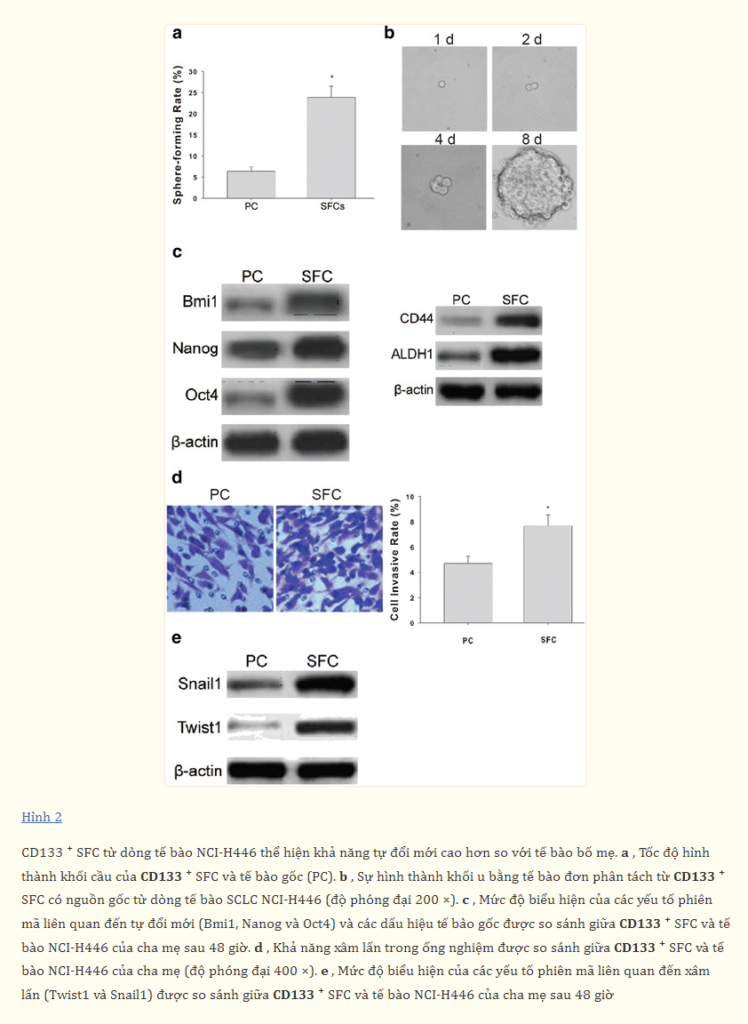
Cân nhắc rằng CSCs có thể đóng một vai trò quan trọng trong quá trình di căn ung thư sớm, chúng tôi tiếp tục kiểm tra khả năng xâm lấn của CD133+ SFCs và tế bào gốc. Kết quả cho thấy CD133+ SFCs thể hiện khả năng xâm lấn in vitro cao hơn tế bào gốc. Kết quả Western blot cũng cho thấy so với tế bào gốc, CD133+ SFCs biểu hiện mức độ cao hơn của các yếu tố phiên mã liên quan đến EMT là Twist1 và Snail1 (Hình 2d và 2e).
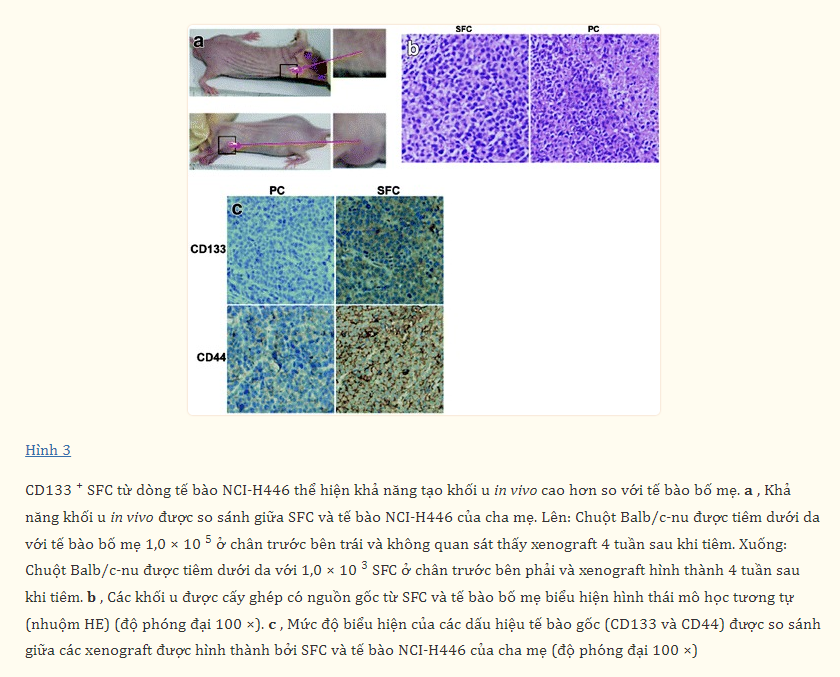
Hơn nữa, kết quả thí nghiệm gây khối u in vivo cho thấy 1 × 10^3 tế bào CD133+ SFCs có thể bắt đầu hình thành khối u sau 18 ngày tiêm vào chuột Balb/c-nu, so với 31 ngày thời gian tiềm ẩn gây khối u đối với 1 × 10^5 tế bào gốc (Bảng 1, Hình 3a). Trong khi đó, kết quả nhuộm cho thấy các khối u được cấy ghép có nguồn gốc từ CD133+ SFCs và tế bào gốc thể hiện hình thái mô học tương tự nhau (Hình 3b). Những kết quả này chỉ ra rằng CD133+ SFCs cho thấy tiềm năng gây khối u cao hơn so với tế bào gốc. Và kết quả miễn dịch mô học cũng cho thấy tần suất các tế bào biểu hiện CD133 và CD44 trong các mô khối u có nguồn gốc từ CD133+ SFCs cao hơn đáng kể so với các mô có nguồn gốc từ tế bào gốc (Hình 3c). Những phát hiện này hoàn toàn ủng hộ giả thuyết của chúng tôi rằng sự làm giàu LCSLCs đã góp phần vào tiềm năng gây khối u cao của CD133+ SFCs. Tóm lại, tất cả những phát hiện trên cho thấy rằng CD133+ SFCs sở hữu các đặc điểm của CSCs và có thể được định nghĩa là LCSLCs.

FVTF ức chế khả năng tự làm mới của LCSLCs
Khả năng tự làm mới là đặc điểm chính của CSCs, cho phép CSCs khởi xướng và duy trì khối u liên tục. Do đó, việc khám phá các loại thuốc hóa trị mới có thể nhắm mục tiêu vào con đường tự làm mới của CSCs sẽ cực kỳ quan trọng đối với liệu pháp điều trị ung thư. Kết quả trong nghiên cứu này cho thấy FVTF (0,1, 1, 3, 10, 30 μg/mL) có thể ưu tiên ức chế sự tăng sinh của LCSLCs theo cách phụ thuộc vào nồng độ và IC50 là 0,7 μg/mL, so với IC50 là 3,7 μg/mL đối với các tế bào gốc (Hình 4a). Hơn nữa, kết quả thử nghiệm tạo khối cầu khối u cũng chứng minh rằng FVTF (0,5, 1,0, 2,0 μg/mL) đều có thể làm giảm đáng kể tỷ lệ tạo khối cầu khối u nguyên phát và thứ phát của LCSLCs (Hình 4b và 4c). Những phát hiện này chỉ ra rằng FVTF có thể ức chế khả năng tự làm mới của LCSLCs. Phù hợp với những phát hiện trên, kết quả phân tích Western blot cũng cho thấy FVTF (0,5, 1,0, 2,0 μg/mL) làm giảm mức độ biểu hiện của các yếu tố phiên mã liên quan đến tự làm mới Bmi1, Nanog và Oct4 theo cách phụ thuộc vào nồng độ (Hình 4d).
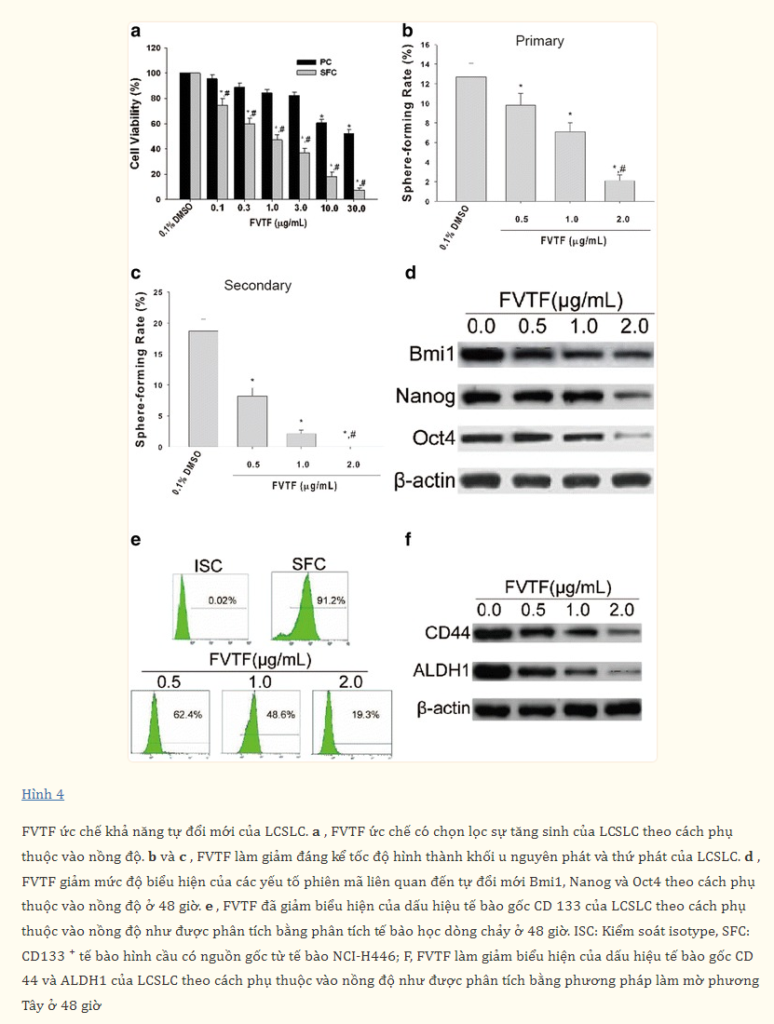
FVTF làm giảm biểu hiện các dấu ấn tế bào gốc của LCSLCs
Để nghiên cứu tác động của FVTF lên biểu hiện các dấu ấn tế bào gốc của LCSLCs, chúng tôi đã kiểm tra mức độ biểu hiện của CD133, CD44 và ALDH1 bằng phương pháp phân tích tế bào dòng chảy hoặc Western blot. Như thể hiện trong Hình 4e và 4f, FVTF làm giảm biểu hiện các dấu ấn tế bào gốc CD133, CD44 và ALDH1 của LCSLC theo cách phụ thuộc vào nồng độ.
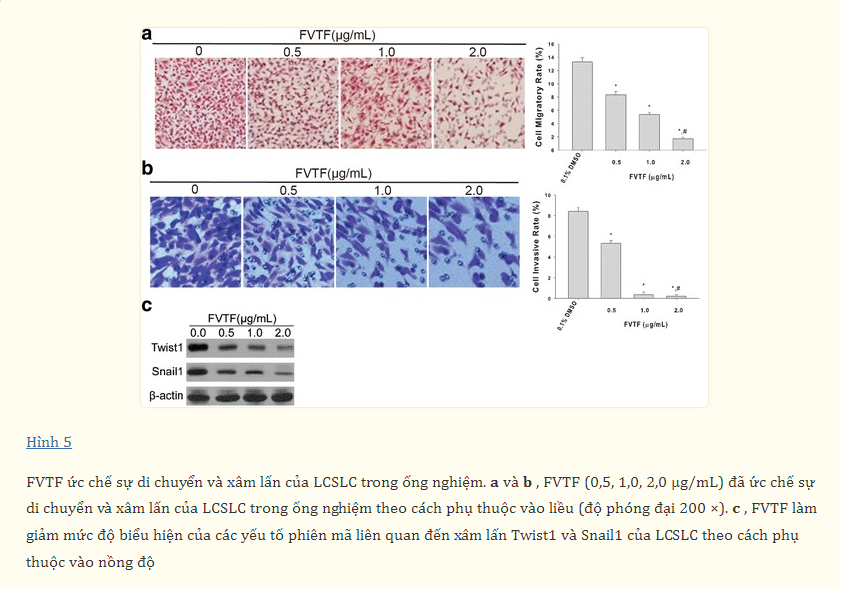
FVTF ức chế sự di chuyển và xâm lấn của LCSLCs trong ống nghiệm
Hơn nữa, chúng tôi muốn kiểm tra tác động của FVTF lên khả năng di chuyển và xâm lấn của LCSLCs trong ống nghiệm. Kết quả Transwell cho thấy FVTF (0,5, 1,0, 2,0 μg/mL) ức chế sự di chuyển và xâm lấn của LCSLCs trong ống nghiệm theo cách phụ thuộc vào liều lượng (Hình 5a và 5b). Phù hợp với những phát hiện này, chúng tôi nhận thấy rằng các yếu tố phiên mã liên quan đến xâm lấn Twist1 và Snail1 của LCSLCs bị giảm đáng kể sau khi điều trị bằng FVTF ở các nồng độ khác nhau (Hình 5c).
FVTF ức chế đặc điểm của LCSLCs thông qua việc điều hòa giảm p-Akt
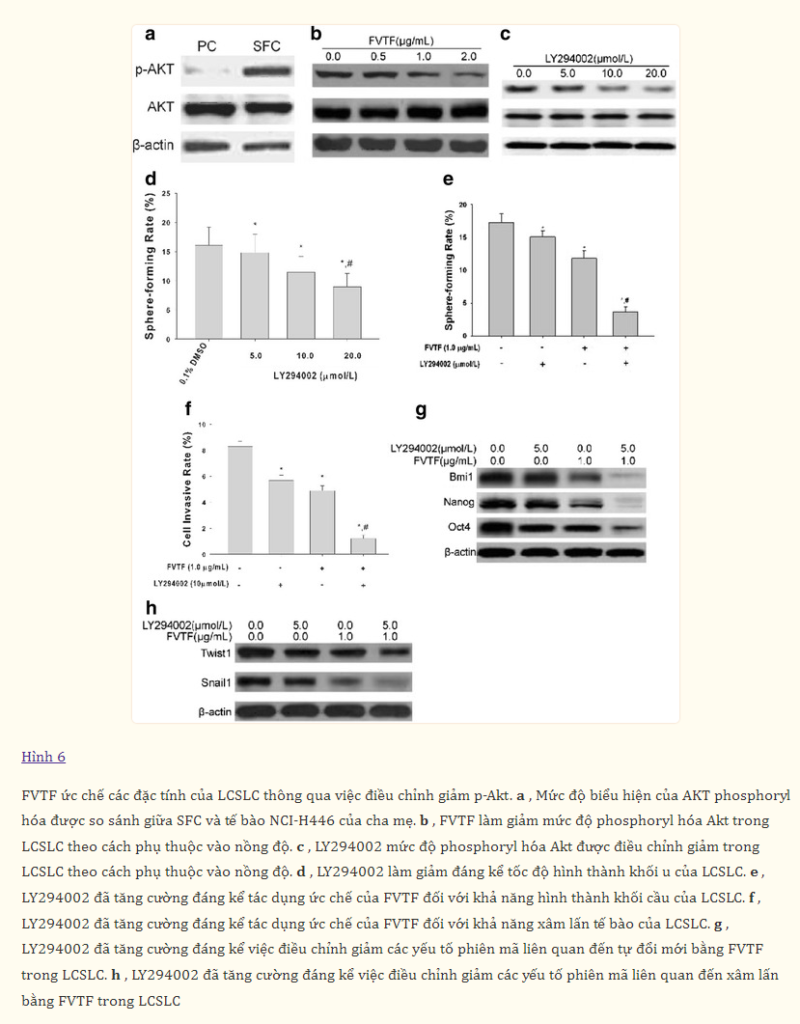
Đã có báo cáo rằng con đường PI3K-Akt có thể thúc đẩy khả năng tự làm mới của tế bào gốc tạo máu (HSCs) thông qua việc điều hòa nhóm protein polycomb bao gồm Bmi1. Do đó, chúng tôi đã kiểm tra mức độ phosphoryl hóa của AKT trong LCSLCs. Kết quả phân tích Western blot cho thấy sự hoạt hóa của AKT được nâng cao đáng kể trong LCSLCs so với trong các tế bào gốc (Hình 6a). Và điều trị bằng FVTF (0,5, 1,0, 2,0 μg/mL) có thể làm giảm đáng kể mức độ phosphoryl hóa của Akt trong LCSLCs (Hình 6b). Hơn nữa, một chất ức chế đặc hiệu PI3K LY294002 đã được sử dụng trong nghiên cứu tiếp theo. Như thể hiện trong Hình 6c, LY294002 ở các nồng độ khác nhau có thể làm giảm hiệu quả mức p-Akt của LCSLCs có nguồn gốc từ tế bào NCI-H446. Chúng tôi cũng nhận thấy rằng biểu hiện p-Akt bị điều hòa giảm bởi LY294002 đã ức chế đáng kể khả năng tự làm mới của LCSLCs (Hình 6d). Hơn nữa, kết quả cho thấy LY294002 (5,0 μM) có thể làm giảm hiệu quả tỷ lệ hình thành khối cầu (Hình 6e) và tỷ lệ xâm lấn tế bào (Hình 6f) của LCSLCs do FVTF (1,0 μg/mL) ức chế xuống mức thấp hơn, kèm theo biểu hiện của các yếu tố phiên mã liên quan đến tự làm mới và xâm lấn của LCSLCs giảm hơn nữa (Hình 6g và 6h). Tóm lại, những phát hiện này chỉ ra rằng sự hoạt hóa liên tục của Akt có liên quan đến việc duy trì khả năng tự làm mới của LCSLCs, và mức độ phosphoryl hóa của Akt giảm đã góp phần vào các đặc tính tế bào gốc của LCSLCs bị ức chế FVTF.
THẢO LUẬN
Mặc dù đã có nhiều nỗ lực để chống lại bệnh ung thư phổi, căn bệnh này vẫn là nguyên nhân gây tử vong do ung thư hàng đầu ở Trung Quốc. Hiện nay, người ta thường chấp nhận rằng LCSLCs là tế bào gây khối u quyết định chịu trách nhiệm cho sự khởi phát, phát triển, di căn và tái phát ung thư phổi sau hóa trị. Do đó, việc tiêu diệt mục tiêu LCSLCs là cực kỳ quan trọng để cải thiện tiên lượng hoặc thậm chí là phục hồi ung thư phổi.
Trong nghiên cứu hiện tại, chúng tôi đã phân lập, làm giàu và thu được CD133+ SFCs từ các tế bào NCI-H446 ung thư phổi ở người, bằng phương pháp phân tách từ tính CD133+ và phương pháp nuôi cấy huyền phù môi trường điều hòa tế bào gốc. Các kết quả sau đây đã xác nhận rằng phân nhóm tế bào này thể hiện khả năng tự làm mới, xâm lấn và tạo khối u in vitro cao hơn so với tế bào gốc, kèm theo mức độ biểu hiện tăng cao của các dấu hiệu tế bào gốc, các yếu tố phiên mã liên quan đến tự làm mới và xâm lấn. Nhìn chung, các SFCs này thể hiện các đặc điểm giống tế bào gốc và được định nghĩa là LCSLCs.
Ngày càng có nhiều dữ liệu mới nổi báo cáo rằng các yếu tố phiên mã Bmi1, Nanog và Oct4 có liên quan đến việc điều chỉnh khả năng tự làm mới và biệt hóa đa hướng của CSCs và tế bào gốc trưởng thành. Park IK và cộng sự đã báo cáo rằng Bmi1, một thành viên của nhóm protein polycomb, rất cần thiết để duy trì tế bào gốc tạo máu tự đổi mới ở người trưởng thành. Một nghiên cứu khác của Abdouh M et al. cũng tiết lộ rằng các protein PcG có liên quan đến sự phát triển khối u đa dạng Glioblastoma (GBM) và cần thiết để duy trì sự đổi mới của tế bào gốc khởi tạo ung thư. Nanog và Oct4 là các yếu tố phiên mã cốt lõi duy trì khả năng tự làm mới và biệt hóa đa năng của tế bào gốc phôi. Đã có báo cáo rằng việc đồng biểu hiện Oct4 và Nanog thúc đẩy quá trình di căn của ung thư biểu mô tuyến phổi bằng cách tạo ra các đặc tính giống tế bào gốc ung thư và biệt hóa biểu mô trung mô. Trong nghiên cứu này, chúng tôi phát hiện ra rằng Bmi1, Nanog và Oct4 được biểu hiện cao trong các SFC có nguồn gốc từ tế bào NCI-H446 so với các tế bào gốc, được xác nhận bằng phân tích Western blot. Nó chỉ ra rằng các SFCs sở hữu khả năng tự làm mới và biệt hóa đa năng.
Người ta thường chấp nhận rằng hầu hết các trường hợp tử vong liên quan đến ung thư là do sự xâm lấn cục bộ và di căn xa, chứ không phải do khối u nguyên phát. CSCs được coi là đóng một vai trò quan trọng trong quá trình di căn sớm của nhiều loại khối u ác tính ở người bao gồm ung thư phổi. Trong nghiên cứu của chúng tôi, các xét nghiệm Transwell đã chứng minh rằng SFCs có nguồn gốc từ tế bào NCI-H446 thể hiện khả năng xâm lấn in vitro cao hơn tế bào gốc. Những kết quả này cho thấy rằng SFCs có khả năng xâm lấn và di căn cao. Protein liên quan đến sự xâm lấn Snail là một thành viên của siêu họ yếu tố phiên mã kẽm. Đã có báo cáo rằng Snail có thể trực tiếp hoặc gián tiếp làm trung gian cho quá trình chuyển đổi biểu mô-trung mô (EMT) dẫn đến sự xâm lấn và di căn của tế bào khối u. Trong thực hành lâm sàng, việc biểu hiện quá mức Snail có liên quan đến tiên lượng xấu và tăng khả năng xâm lấn ở một số loại bệnh nhân ung thư. Twist1, thuộc họ yếu tố phiên mã basic Helix-Loop-Helix (bHLH), là một yếu tố phiên mã được bảo tồn cao trong quá trình tiến hóa, lần đầu tiên được tìm thấy ở Drosophila và ban đầu tham gia vào sự phát triển phôi bằng cách góp phần vào quá trình di chuyển tế bào. Một nghiên cứu của Mikheeva và cộng sự đã báo cáo rằng TWIST1 thúc đẩy sự xâm lấn thông qua việc kích hoạt các thay đổi phân tử và tế bào trung mô trong u nguyên bào thần kinh đệm ở người. Li và cộng sự đã tiết lộ rằng sự suy giảm Twist1 đã chặn hoàn toàn quá trình chuyển đổi trung mô do Adriamycin gây ra. Nghiên cứu trước đây của chúng tôi cũng phát hiện ra rằng tín hiệu Twist có liên quan đến việc duy trì khả năng tự làm mới và xâm lấn của tế bào gốc ung thư gan. Trong nghiên cứu này, chúng tôi đã chỉ ra rằng các yếu tố phiên mã liên quan đến EMT là Snail và Twist1 được biểu hiện cao trong SFCs so với các tế bào gốc. Mặc dù chưa có biện pháp điều chỉnh biểu hiện gen nào được thực hiện thêm, chúng tôi có lý do để suy đoán rằng khả năng xâm lấn cao của SFCs có thể liên quan đến mức độ biểu hiện cao của Snail1 và Twist.
Trả lời